
题目列表(包括答案和解析)
1、某结晶水合物的化学式为A·H2O,其相对分子质量为B,在60℃时m g 该晶体溶于ng水中,得到v mL 密度为d g· mL-1 的饱和溶液,下述表达式或判断正确的是
A.该溶液物质的量浓度为(1000m/BV)mol·L-1
B.60℃时A 的溶解度为(100m(B-18)/nB)g
C. 该溶液溶质的质量分数为(m/(m+n))×100%
D.60℃时,将10g A 投入到该饱和溶液中,析出晶体大于l0g
20.(7)现有A、B、C、D四种短周期非金属元素,它们的原子最外层电子数之和为19。在它们的化合物中,主要化合价均不止一种,但有一种相同的化合价。它们的一些物理常数如下:
|
元素 |
A |
B |
C |
D |
|
原子半径/nm |
0.102 |
0.077 |
0.117 |
0.075 |
|
单质沸点/℃ |
444.6 |
4827 |
2355 |
-195.8 |
(1)A元素在元素周期表中的位置为 。
(2)在常温下,B与C的最高价氧化物分别为气态和固态,原因是
。
(3)含D元素的两种常见共价化合物发生化合反应可生成一种离子化合物,该反应的化学方程式为 。
(4)A、B、C、D均可形成分子中含18个电子的氢化物,这些氢化物的分子式为
(写出3种即可)。
k+s-5#u

19.(10分)X、Y、Z、W是周期表中原子序数依次增大的前20号元素。X、Y同周期。Y、Z同主族,Zn-1与Wn+离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下A为液体,B、C、E、G为气态化合物,且A、C、G均为直线型分子;D 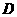 是由元素W、Y形成的常见化合物。w.w.w.k.s.5.u.c.o.m k+s-5#u
是由元素W、Y形成的常见化合物。w.w.w.k.s.5.u.c.o.m k+s-5#u

(1)元素W的名称 ,Z的原子结构示意图 ,A的电子式 。
(2)写出D、E的化学式:D 、E 。
(3)①已知38g A与Y完全反应生成B、C时放出口a kJ的热量,写出该反应的热化学
方程式:
②F与水反应的化学方程式:
18.(10分)有A、B、C、D、E、F六种原子序数依次增大的主族元素,其相关信息如下:
①短周期元素C原子的最外层有4个电子,E单质可在空气中燃烧;
|
C |
D |
E |
|
|
|
F |
②右表是元素周期表中的主族元素的一部分:
③A、B为同周期相邻金属元素,A原子最外层电子数是其电
子总数的1/6;据些回答下列问题:
(1)D的元素符号是 ,F在元素周期表中的位置为 ;
(2)C的最高价氧化物与烧碱溶液反应的离子方程式为 ;
(3)B、E两元素分别形成的简单离子在水溶液中发生反应的离子方程式为
。
17.(16分)A、B、C、D、E是短周期元素,周期表中A与B,B与C相邻,A与C的最外层电子数之比为2:3,B的最外层电子数比E的最外层电子数少一个;常见化合物D2C2与水反应生成C的单质,且溶液可使酚酞试液变红.
(1)E的元素符号是 .
(2)A、B、C的氢化物稳定性顺序为(用分子式表示)
.k+s-5#u 
B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z的晶体类型为
.
AB-离子的电子式为 .
(3)由A、C、D形成化合物的水溶液显碱性,其原因是(用离子方程式表示)
.
(4)一定量的D2C2与AC2反应后的固体物质,恰好与0.8mol稀盐酸溶液完全反应,并收集到0.25mol气体,则用物质的量表示该固体物质的组成为 、
.
16.(12分)下图为元素周期表中前4周期的表格。
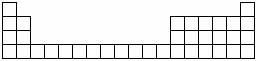
甲是一种常见化合物,其化学式为XC13。
(1)根据你所学知识,将X代表的元素符号,填在所给周期表的表格中对应的位置(要求写出2种)
(2)若将一种XC13水溶液蒸干、灼烧,得到红棕色粉末X2O3,则含碳的X合金在潮湿的空气中发生电化腐蚀时反应的化学方程式为 。
(3)若X代表另一种金属单质,该单质可与(2)中所述的粉末发生反应,则该种X元素的原子结构示意图为 ;该X单质与(2)中所述粉末组成的混合物可称为 ,该反应可用于 。(写出一种用途)。
15.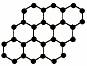 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是 ( )
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是 ( )
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含有6.02×1022个碳原子k+s-5#u

C.石墨烯是一种有机物
D.石墨烯中的碳原子间以共价键结合
第Ⅱ卷(非选择题 55分)
14.一定条件下,氨气和氟气可以发生反应:4NH3+3F2=NF3+3NH4F,其中NF3分子空间构型与NH3相似。下列说法错误的是 ( )
A.NF3是由极性键构成的极性分子
B.氧化产物只有NF3,还原产物有NF3和NH4F k+s-5#u

C.4 mol NH3被氧化时转移电子的物质的量为6 mol
D.NH4F属于离子晶体,既含有离子键又含有共价键
13.下表数据是对应物质的熔点/℃
|
NaCl |
Na2O |
AlF3 |
AlCl3 |
BCl3 |
Al2O3 |
CO2 |
SiO2 |
|
801 |
920 |
1291 |
190 |
-109 |
2073 |
-57 |
1723 |
据此,下列判断错误的是: ( )
A.AlF3晶体与AlCl3晶体的晶体类型相同
B.BCl3与CO2晶态时,均属分子晶体,且BCl3与CO2均为非极性分子
C.同族元素的化合物可形成不同类型的晶体k+s-5#u

D.离子键的强弱与离子电荷的高低和半径的大小相关
12. X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+2。下列说法正确的是 ( )
A.X、Y、Z、W的原子序数依次增大
B.Y不能把溴从溴化物中置换出来
C.Z的氧化物通常形成分子晶体
D.存放W单质的仓库失火不能用CO2灭火
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com