
题目列表(包括答案和解析)
4.恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
若反应进行到某时刻t时,nt(N2)=13mol ; nt(NH3)=6 mol,计算a的值。
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合物气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)= 。
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比,α(N2):α(H2)= 。
(6)平衡混合气体中,n(N2):n(H2):n(NH3)= 。
3.在830 K时,可逆反应CO+H2O?H2+CO2,及其平衡具有某些特殊性。若起始浓度[CO]为2 mol/L,[H2O]为3 mol/L,反应达到平衡时,CO转化为CO2的转化率为60%;如果将H2O的起始浓度加大到6 mol/L,则CO的转化率为75%。
请观察上述有关数据,找出规律,填写以下空白。
设830K时,起始浓度[CO]为a mol/L,[H2O]为b mol/L,反应达到平衡时[H2]为c mol/L。(1)当b不变,a减小,重新达到平衡时,CO的转化率 ,H2O的转化率 。(填“增大”、“减少”或“不变”)
(2)a=5,c= 20/9 时,b= 。 (3)当a=b时,c/a = 。
(4)a、b、c在该平衡中的关系式是 。
2.在一定体积的密闭容器中,进行如下化学反应:C02(g)+H2(g)?C0(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中c(C0)不变 c.v正(H2)= v逆(H20) d.c(CO2)=c(C0)
 (4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H20),试判断此时的温度为 ℃。
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H20),试判断此时的温度为 ℃。
2.根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol·L-1·min-1。
(2)在实验2,A的初浓度C2= ,mol·L-1,反应经20分钟就达到平衡,可推测实验
2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<)。且C3
1· mol·L-1 (填>、=、<)。
(4)比较实验4和实验l,可推测反应是 反应(选填吸热、放热)。理由是 。
1.某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度为O。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
|
实验 序号 |
时间 浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.20 |
0.20 |
0.20 |
0.20 |
0.20 |
21.一定条件下,向一带活塞的密闭容器中充入2 molSO2和1 molO2,发生下列反应:2SO2(g)+O2(g)?2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A.保持温度和容器体积不变,充入1 molSO2(g)
B.保持温度和容器内压强不变,充入1 molSO3(g)
C.保持温度和容器内压强不变,充入1 molO2(g)
D.保持温度和容器内压强不变,充入1 molAr(g)
20.在一定温度下,一定体积的密闭容器中有如下平衡:H2(气)+I2(气)?2HI(气)。已知H2和I2的起始浓度均为0.1mol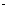 L-1,达平衡时HI的浓度为0.16mol
L-1,达平衡时HI的浓度为0.16mol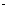 L-1。若H2和I2的起始浓度均变为0.2 mol
L-1。若H2和I2的起始浓度均变为0.2 mol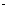 L-1时,则平衡时H2的浓度(mol
L-1时,则平衡时H2的浓度(mol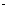 L-1)是 ( )
L-1)是 ( )
A.0.16 B.0.08 C.0.04 D.0.02
19.下图I、Ⅱ、Щ分别代表反应①③、②、④,则y轴是指 ( )
①N2+3H2 2NH3
2NH3  H<0
H<0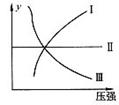
②H2+I2(g) 2HI
2HI  H<0
H<0
 ③CO+2H2
③CO+2H2 CH3OH(g)
CH3OH(g) H<0 ④2SO3
H<0 ④2SO3  2SO2+O2
2SO2+O2 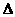 H>0
H>0
A.平衡混合气中一种生成物的百分含量 B.平衡混合气中一种反应物的百分含量
C.平衡混合气中一种生成物的转化率 D.平衡混合气中一种反应物的转化率
18.在一密闭容器中,用等物质的量的A和B发生如下反应:A(气)+2B(气) 2C(气)反应达到平衡时,A的转化率为0.4。则平衡混合物中物质的量n(A)、n(B)和n(C)应满足的关系是( )
2C(气)反应达到平衡时,A的转化率为0.4。则平衡混合物中物质的量n(A)、n(B)和n(C)应满足的关系是( )
A.n(A)=n(C) B.n(B)=n(C) C.n(A)+n(B)=n(C) D.n(B)+n(C)=n(A)
17.已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是 ( )
A.Q1=2Q2=92.4 B.Ql>2Q2 C.Q1<2Q2 D.Q1=2Q2≠92.4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com