
题目列表(包括答案和解析)
3.下列仪器:①烧杯②坩埚③锥形瓶④蒸发皿⑤试管⑥烧瓶⑦表面皿,用酒精灯加热时.需垫石棉网的是 ( )
A②④⑤ B.①⑥⑦ C.⑦④⑥ D.①③④⑥
2.下列物质的溶液中,不易被氧化,不易分解,且能存放在玻璃试剂瓶中的是 ( )
A.氢氟酸 B.硝酸 C. 石炭酸 D.乙酸
1.少量下列化学药品应保存在水里的是 ( )
A.金属钾 B.白磷 C.硫磺 D.苯
9.X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是 ;
②生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是 ;
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
。
8.如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下
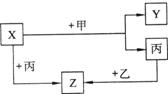 转化关系:
转化关系:
(1)若甲是具有还原性的金属单质,X、Y、Z中有一种是离子晶体,试推断:
①X、Y、Z中含有丙元素的是 (填写物质的化学式);
②此时,Z是 气的主要成分;
③X与甲反应的化学方程式是
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是暗红色的液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子。试推断:
①写出甲、乙、丙三种物质的化学式 ;
②写出X与足量的甲在溶液中完全反应的离子方程式 。
7.如下图所示,已知:
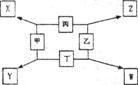
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1:3反应,分别生成 X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比l:2反应,分别生成Z和W,在产物中元素乙呈负价;
请填空:
(1)甲是 , 乙是 。
(2)甲与丙反应生成X的化学方程式是:
(3)乙与丁反应生成W的化学方程式是:
6.用Cl2消毒会使饮用水中的有机物发生氯化,生成有机氯化合物,于人体有害。世界环保联盟即将全面禁止用氯气对饮用水消毒。建议推广采用广谱性高效消毒剂ClO2。
(1)使用ClO2作饮用水消毒剂的优点是:
(2)目前,欧洲一些国家用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,该反应的化学方程式是:
(3)我国最近研究成功ClO2氧化亚氯酸钠(N2保护下)制ClO2,其反应的化学方程式为:
这一反应的优点是:
(4)在H2SO4存在的条件下,用Na2SO3还原NaClO3也可制ClO2,其反应的化学方程式为:
5.环保检测中,有害气体的浓度常用1L气体样品中含有害气体的毫克值(mg/L)来表示,如对某气体样品中所含CO的浓度进行测定,其方法和步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL5.00×10-3mol/L的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:
I2+2S2032- =2I-+S4O62-;
③将②中溶液取出1/5,加入1.00mLl.00×10-2mol/L碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化。
(1)写出步骤①中CO通过盛I2O5加热管的有关反应的化学方程式。
(2)计算样品中CO的浓度。
4.减少汽车尾气造成环境污染的方法之一是在汽车的排气管上安装“催化转换器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧和SO2的转化。
(1)写出CO与NO反应的化学方程式: 。
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是 。
3.为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com