
题目列表(包括答案和解析)
4. 把4.6g钠投入到95.6g水中,发生化学反应。假设无水蒸发现象,所得溶液中溶质的质量分数是( )
3. 由Zn,Fe,Al,Mg四重金属中两种组成的混合物10g,与足量的盐酸反应产生的H2在标准状况下为11.2L,则混合物中一定含有的金属( )
2. 将金属钠2.3g放入100g水中,完全反应后溶液的质量分数为( )
1. 4.6g纯净金属钠在干燥的空气中被氧化后,得到7.0g固体,由此可判断出其氧化产物是( )
12、由H2、C2H4、C2H2组成的1L混合气体,在一定条件下发生加成反应后,气体总体积变成了XL。请回答(气体体积均在标准状况下测定)
⑴当反应后三种气体均无剩余时,X的取值范围是 ;
⑵若反应后三种气体均无剩余,X=0.4时,原混合气体H2、C2H4、C2H2的体积比为 ;
⑶若X=0.6时,且反应后混合气体密度为0.714g/L时,原混合气体H2、C2H4、C2H2的体积之比为 。
答案:⑴1/3<X<1/2 ⑵3:1:1 ⑶7:2:1
解析:(1)用极值法。若1L混合气体为H2和C2H4,二者刚好完全反应,V(H2)=V(C2H4)=0.5L,
则X=0.5;若1L混合气体为H2和C2H2,二者刚好完全反应,V(H2):V(C2H4)=2:1,
则X=1/3 ,故1/3<X<1/2;
(2)若X=0.4,假设混合气体中C2H4有aL、C2H2bL,则有a+a+b+2b=1;a+b=0.4,解得a=b=0.2,故H2、C2H4、C2H2的体积比=3:1:1;
(3)反应后混合气体的平均相对分子质量=0.714g/L×22.4L/mol=16g/mol,因此可以推定混合气体中必有过量的H2,则反应后混合气体为H2和C2H6,用十字交叉法可以算出反应后混合气体中V(H2)=V(C2H6)=0.3L,假设C2H4有aL、C2H2bL,则a+b=0.3;(a+b)+(a+2b)=0.7,解得a=0.2,b=0.1.
11.氯乙烯是合成聚氯乙烯的单体。乙烯氧化法是生产氯乙烯的主要方法。分三步进行,如下图所示:
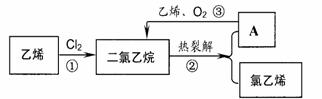
 (1)关于乙烯、氯乙烯、聚氯乙烯说法正确的是__________(填字母)
(1)关于乙烯、氯乙烯、聚氯乙烯说法正确的是__________(填字母)
A.都能在氧气中燃烧 B.都能发生加成反应使溴水褪色
C.都能使得酸性高锰酸钾褪色 D.氯乙烯分子中所有原子共平面
(2)从环境角度考虑,氧化法的优点是____________________
(3)请写出③化学方程式__________________
(4)焚烧废旧塑料过程中会排放有毒物质。写出聚乙烯塑料完全燃烧的化学方程式
答案:(1)AD (2) 利用二氯乙烷热裂解所产生的氯化氢作为氯化剂,从而使氯得到完全利用,不向环境排放毒害气体。
(3)2 C2H4 +O2 +4HCl→2C2H4Cl 2+2H2O
 (4)
(4)
解析:(1)聚氯乙烯中不含碳碳双键,故B、C错误;乙烯分子中所有原子共平面,氯乙烯可以看成是氯原子取代了氢原子,因此氯乙烯分子中所有原子也共平面。
(3)二氯乙烷热裂解生成氯乙烯和氯化氢;
(4)聚乙烯塑料完全燃烧生成的有毒物质是氯化氢,其他产物是CO2和H2O。
10.经研究发现白蚁信息素有: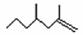 (2,4-二甲基-1-庚烯) ,
(2,4-二甲基-1-庚烯) , (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。试完成下列问题:
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。试完成下列问题:
(1)下列说法不正确的是 。
A.以上三种信息素均难溶于水
B.以上三种信息素均能使溴的四氯化碳溶液褪色
C.以上三种信息素互为同系物
D.家蚕信息素可发生氧化、加成、加聚、取代反应
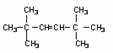
(2)烯烃A是2,4-二甲基-1-庚烯的一种同分异构体,A与足量氢气加成得到烷烃B,B的一氯代物只有2种; 烯烃C是3,7-二甲基-1-辛烯的一种同分异构体,C与氢气加成得到烷烃D,D的一氯代物也只有2种,则B的结构简式为: 或 ;C的结构简式为: 。
解析:(1)单烯烃与二烯烃的分子组成相差不是(CH2)n,不可能互为同系物,故C错误;
(2)B分子式为C9H20,一氯代物只有2种,说明其分子结构有高度对称性,若等效甲基多,则结构简式为C(CH3)3CH2 C(CH3)3,若等效乙基多,则结构简式为C(C2H5)4,则不难推出C的结构简式为C(CH3)3CH=CH C(CH3)3。
答案.(1)C
(2)C(CH3)3CH2
C(CH3)3、 ;
;
9.某课外活动小组利用乙炔与酸性KMnO4溶液反应测定乙炔的相对分子质量,下图是测定装置的示意图。B中的CuSO4用于除去乙炔中混有的H2S、PH3、AsH3等还原性气体。


⑴装置A中发生反应的化学方程式为 ;
为得到平稳的乙炔气流,液体a是 。
⑵ 请配平C2H2与酸性KMnO4溶液反应的化学方程式(在横线中填计量数):
___C2H2+___KMnO4+___H2SO4 == ___K2SO4 +____MnSO4+____CO2↑+____H2O
⑶实验前D中含有x mol的KMnO4,实验时向D中通入一定量的乙炔直至酸性KMnO4溶液恰好完全褪色,实验完毕后装置D及E的总质量共增重y g,请通过计算求出所测乙炔的相对分子质量(请用含字母x、y的代数式表示): (不写计算过程)。
⑷若该小组的实验原理及所有操作都正确,下列因素中,对所测乙炔相对分子质量的值不会产生影响的是:____ 。
A.将装置A中产生的混合气体直接通入D中的酸性KMnO4溶液
B.将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
C.通入过量纯净的乙炔气体于酸性KMnO4溶液时,有部分乙炔未被氧化而逸出
⑸另一活动小组的同学认为上述实验装置仍存在不足,请你用简要的文字说明改进的措施 。
 答案:(1)CaC2+2H2O
Ca(OH)2 + C2H2 ↑;饱和食盐水
答案:(1)CaC2+2H2O
Ca(OH)2 + C2H2 ↑;饱和食盐水
⑵ 1、2、3、1、2、2、4 ; ⑶ 2y/x;⑷ C
⑸在E装置后面再接一个盛有碱石灰的干燥管;
解析:(2)方程式配平时,乙炔中碳元素化合价为-1,升高10价,KMnO4到MnSO4降低5价,所以KMnO4和MnSO4前的计量数都为2;(3)实验中装置D及E增加的总质量就是参加反应的乙炔的质量,再根据配平的化学方程式可知,每2mol KMnO4完全反应增加的质量等于乙炔的相对分子质量,可得Mr(C2H2)=2y/x 。
(4)此实验成功的关键,一是通入酸性KMnO4溶液的气体是干燥纯净的乙炔,二是E装置能够吸收反应产生的CO2和水蒸气,因此应该在E装置后再接一个盛有碱石灰的干燥管,以排除空气中CO2和水蒸气对实验的干扰。
8.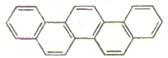 第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功。下图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃。下列说法正确的是
第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功。下图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃。下列说法正确的是
A.该有机物属于芳香族化合物,是苯的同系物
B.该有机物是只含非极性键的非极性分子
C.该有机物的一氯代物只有一种
D.该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量
答案:D
解析:与苯互为同系物的芳香烃应满足2个条件:只含一个苯环、烃基为烷烃基,故A错误;该有机物含有碳氢键,属于极性键,B错误;该有机物的一氯代物有7种,C错误。
7.鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性。实验测得角鲨烯分子是链状结构,分子中含有30个碳原子且碳氢质量比为7.2:1,下列说法不正确的是
A.角 鲨烯分子式为C30H50
鲨烯分子式为C30H50
B.角 鲨烯完全加氢后为C30H60
鲨烯完全加氢后为C30H60
C.1mol角鲨烯最多可与6mol溴单质加成
D.角鲨烯与分子式为C29H48的物质可能属于同系物
答案:B
解析:根据碳氢质量比为7.2:1可计算得出角 鲨烯分子式为C30H50,A正确;角鲨烯分子C30H50比烷烃C30H62少12个H原子,分子中最多含有6个碳碳双键,故C正确;C29H48与与C30H50相差CH2,D正确。角鲨烯分子是链状结构,完全加氢后为C30H62。
鲨烯分子式为C30H50,A正确;角鲨烯分子C30H50比烷烃C30H62少12个H原子,分子中最多含有6个碳碳双键,故C正确;C29H48与与C30H50相差CH2,D正确。角鲨烯分子是链状结构,完全加氢后为C30H62。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com