
题目列表(包括答案和解析)
2.甲型H1N1流感可防、可控、不可怕,通常人们在疫区四处喷洒石灰。根据有关化学知识判断,下列说法中不正确的是
A.生石灰与水反应生成的氢氧化钙溶液显碱性,可以使病毒蛋白质变性,病毒失去生理活性
B.饱和石灰水中加入生石灰,在温度不变的情况下,溶液的pH不变
C.饱和石灰水中加入生石灰,在温度不变的情况下,溶液中溶解的氢氧化钙的量不变
D.给饱和石灰水升温,c(Ca2+)降低
1.CCTV-10的“走近科学”栏目披露一“大仙”的行骗伎俩:其用嘴通过竹筒向一小布包吹气,一段时间后布包冒烟继而燃烧,“大仙”立即判断该屋内有鬼。请利用化学知识判断小布包中装有的物质可能是( )
A.Ca(OH)2 B.Na2O2 C.Fe2O3 D.Mg
26. (9分)右图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1
CH3COOH溶液过程中溶液pH的变化曲线。请回答:
(9分)右图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1
CH3COOH溶液过程中溶液pH的变化曲线。请回答:
(1)B点溶液呈中性,有人据此认为,在B点
时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正 确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)
(2)关于该滴定实验,从下列选项中选出最恰当的一项 (选填字母)
|

(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。(填“>”、“<”或“=”)
25.(9分)已知稀溴水和稀氯化铁溶液都呈黄色,若在足量的稀氯化亚铁溶液中,加入1-2 滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)仅限选用的仪器和试剂有:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉碘化钾溶液,完成以下实验探究过程:
[提出假设]
假设①:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学式,下同)。
假设②:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
[设计实验方案]
为了验证上述假设①和假设②的推断,请用简要的文字说明你的实验方案:
假设①方案: 。
假设②方案: 。
(2)根据高中所学的知识判断,你认为 (填“假设①”或“假设②”)的推断是正确的;若选用淀粉碘化钾溶液验证你的假设是否可行? (填“可行”或“不可行”)理由是_______________ 。
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为:
。
23.(12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:

a.6CO2+6H2O C6H12O6+6O2

b.CO2+3H2 CH3OH+H2O

 c.CO2+CH4 CH3COOH
c.CO2+CH4 CH3COOH
d.2CO2+6H2 CH2==CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
 在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
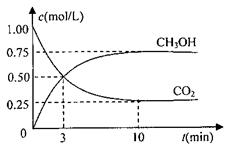 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将 (填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
 N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol
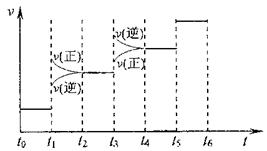 ①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将2amolH2和amolN2放入右图所示的密闭容器中,如果活塞能左右自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将2amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为 。
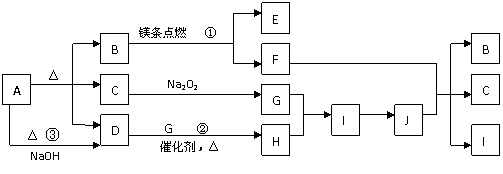 24:(6分)下图中A-J分别代表相关反应中的一种物质,已知A分解得到相等物质的量的B、C、D,图中有部分生成物未写出。
24:(6分)下图中A-J分别代表相关反应中的一种物质,已知A分解得到相等物质的量的B、C、D,图中有部分生成物未写出。
请填写以下空白:
(1)写出反应①、②的化学反应方程式:
①_________________________________________________;
②_______________________________________________________。
(2)写出反应③的离子方程式:_____________________。
22. (8分)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感)疫情,防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3 反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是 。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是 。
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中还原剂与氧化剂的物质的量之比为 。
20、已知酸式盐NaHB在水溶液中存在下列反应:①NaHB==Na++HB-,②HB- H++B2-,③HB-+H2O
H++B2-,③HB-+H2O H2B+OH-
H2B+OH-
且溶液中c(H+)>c(OH-),则下列说法一定正确的是( )
A、NaHB为强电解质
B、H2B为强酸
C、NaHB溶液中仅存在HB-、B2-两种含B元素的离子
D、HB-的电离程度小于HB-的水解程度
第II卷 (共50分)
21,(6分)在氯化铁溶液中存在下列平衡:FeCl3+3H2O Fe(OH)3+3HCl;ΔH>0
Fe(OH)3+3HCl;ΔH>0
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体。向这种液体中加入Mg(OH)2固体,产生的现象为
(2)不断加热FeCl3溶液时,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
(4)向FeCl3溶液中滴加石蕊试液,预计可能看到的现象是 。
(5)向FeCl3溶液中通入HCl气体,溶液的pH_____(填减小、增大或不变),
此时FeCl3的水解程度______________.(填减小、增大或不变)
19、用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解。此时若加入100g36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则电解过程中转移电子的物质的量约为( )
A 6mol B 7mol C 8mmol D 9mol
18.甲烷燃料电池(电解质是KOH溶液)的总反应为:CH4+2KOH+2O2 = K2CO3 + 3H2O。 下列有关的说法中不正确的是
A.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
B.该燃料电池在使用过程中电解质溶液的浓度和性质均发生变化
C.负极反应式:CH4+3H2O-8e-=CO32-+7H+
D.正极反应式:2O2+4H2O+8e-=8OH-
17.下列溶液中有关物质的量浓度关系正确的是( )
A.10℃时,pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中:c(OH-)相等
B.25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)=c(NH+4)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中:
C(NH+4)+c(Fe2+)+c(NH3·H2O)=0.3mol·L-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com