
题目列表(包括答案和解析)
4.二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
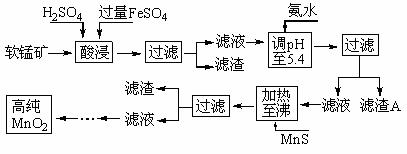
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_________________________。
(2)滤渣A的主要成分是_____________________________。
(3)加入MnS的目的是除去______________________杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为__________________________________。
(5)从废旧碱性锌锰电池中可以回收利用的物质有____________________________(写两种)。
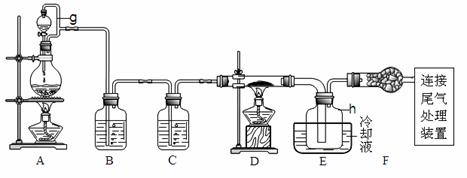
3.(09浙江卷28)(15分)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
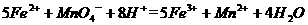
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
2.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110 ℃-140 ℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
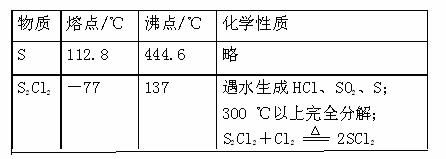
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见______________________________________________ __
______________________________________________________________。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式___________________________________;
E中反应的化学方程式____________________________________。
(3)C、D中的试剂分别是______________、_____________。
(4)仪器A、B的名称是__________、___________,F的作用是____________________________。
(5)如果在加热E时温度过高,对实验结果的影响是___________________________, 在F中可能出现的现象是_________________________________________________。
(6)S2Cl2粗品中可能混有的杂质是(填写两种)_____________、____________,为了提高S2Cl2的纯度,关键的操作是控制好温度和___________________________________。
1.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:

(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网c.泥三角d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、___ __、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是:
、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
20、两种气态烃以一定比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是( )
A、CH4、 C2H4 B、CH4 、C3H6 C、C2H4 、C3H4 D、C2H2 、C3H6
19、一定量的乙醇在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量为55.2g,若其中水的质量为21.6g,则CO2的质量为( )
A.1.4g B.15.6g C.30.8g D.无法计算
18、有机物A、B只可能烃或烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数) ( )
A、8n B、14n C、18n D、44n
17、使m molC2H2跟n mol H2在密闭容器中反应,达到平衡时生成p molC2H4。将平衡混合气体完全燃烧,生成了CO2 和H2O,所需氧气的物质的量为( )mol
A.2.5m+0.5n B.3m+n C.3m+n+2p D.2.5m+0.5n-3p
16.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水。下列说法正确的是,混合气体中( )
A.一定有甲烷 B.一定是甲烷和乙烯 C.一定没有乙烯 D.一定有乙炔
15、下列各组有机物,无论它们以何种物质的量比例混合,只要总物质的量一定,则在完全燃烧时,消耗氧气的量为一恒定值的是( )
A.甲烷、甲醇、甲醛 B.乙烯、苯1,3-丁二烯
C.乙烯、乙醇、丙烯酸 D.乙烯、环丙烷、2一丁烯
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com