
题目列表(包括答案和解析)
1、下列说法中错误的是( )
A、元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
B、除氦原子外,稀有气体原子的最外层电子数都是8
C、原子及其离子的核外电子层数等于该元素所在的周期数
D、同一元素的各种同位素的物理性质、化学性质不一定相同
24、将质量分数为8.8%的NaOH溶液1L(密度为1.06g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了1.0%时停止电解,则此时溶液中应符合的关系是( )
|
|
NaOH的质量分数 |
阳极析出物的质量/g |
阴极析出物的质量/g |
|
A |
9.8% |
19 |
152 |
|
B |
9.8% |
152 |
19 |
|
C |
7.8% |
1.2 |
9.4 |
|
D |
7.8% |
9.4 |
1.2 |
23、用铁做阴极,石墨做阳极电解1LAgNO3溶液中,当电极上析出银的质量为是1.08g时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),则电解液的pH将从6大约变为( ) A.1 B.2 C.3 D.4
22、用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL  KCl溶液和
KCl溶液和
 的
的 溶液,当产生
溶液,当产生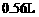 (标准状况)
(标准状况)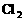 时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500mL)
时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500mL)
A、1.4 B、5.6 C、7 D、12.6
21.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知,氧化性:Fe2+<Ni2+<Cu2+) ( )
A、 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B、电解过程中,阳极质量的减少与阴极质量的增加相等
C、电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D、电解后,电解槽底部的阳极泥中只有Cu和Pt
20、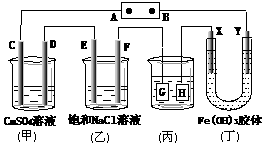 如下图所示的装置,C、D、E、F、X、Y都是
如下图所示的装置,C、D、E、F、X、Y都是
惰性电极。将电源接通后,向(乙)中滴入酚酞
溶液,在F极附近显红色。则以下说法正确的是( )
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质
生成,其物质的量比为1∶2∶3∶2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液选是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
19、下列关于实验现象的描述错误的是( )
A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B、用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌
C、把锌片插入三氯化铁溶液中,在锌片表面可能出现一层铁
D、把铁片放入盛有盐酸的试管中,加入几滴氯化锌溶液,气泡放出速率加快
18、 右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自太阳
C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑
D.燃料电池放电时的负极反应:2H2O +2e-=H2+2OH-
17、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D、放电时正极附近溶液的碱性增强
16、将粗铜精铜和硫酸铜溶液组成电解池,利用电解的方法可以将粗铜提纯。下列有关粗铜精炼的叙述中,正确的是( )
A.粗铜连接电源的负极,发生的电极反应为Cu-2e-=Cu2+
B.阳极发生还原反应
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.由于阳极上铜溶解的速率与阴极上铜沉积的速率相等,所以溶液中硫酸铜的浓度基本保持不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com