
题目列表(包括答案和解析)
11.答案:C
[解析]选项A中CCl4在标准状况下为液体,所以其物质的量时不能用n=V/22.4计算,选项B中n(N2)=0.5mol,1molN2中含有14mol电子,所以0.5molN2含有7NA;选项C中在标准状况下,22.4L的气体为1mol,不管是混合气体还是纯净的气体,所含的分子数均为NA;选项D中生成1molH2,转移的电子数必定为2NA。
10.答案:B
[解析]根据阿伏加德罗定律可知同温同压下气体的密度之比等于摩尔质量之比,即=,由于>1,所以M(甲)>M(乙);由于它们的质量相等,所以甲的物质的量比乙的物质的量少,甲的分子数比乙少;由于它们的外界条件相同,所以它们的摩尔体积相同。
9.答案: C
[解析] A. 1mol 金属钠含有的电子数为11NA,而含有的最外层电子数为1NA;B. 标准状况下苯为液态;C. 0.012kg12C所含的原子数为NA;D. 硫酸分子式为H2SO4,电离时H2SO4=2H++SO42-。因此,所含H+数应为2NA
8.答案:BC
[解析]Fe过量可使Fe3+还原为Fe2+,A错误。3NO2+H2O==2HNO3+NO,易知B正确。C中, 可把N2O4看作2NO2,则有1moLNO2,所以有3mol原子;也可以用极端方法,看作全部NO2或全部N2O4考虑,也可得出结果。3Fe+4H2O===Fe3O4+4H2↑,由方程可知D错误。
7.答案:A
[解析]m(Al):m(NaOH)=27:40;
m(Al(OH)3):m(NaOH)=75:40;
m(AlCl3):m(NaOH)=33.375:40;
m(Al2O3):m(NaOH)=51:40;
所以相同质量的物质,消耗碱量最多的是Al。故选A。
6.答案:D
[考点]本题考查了物质的量的相关计算。
[解析]本题的解题关键是将溶液分成两份,即每份体积为a/2 L ,n(Ba2+)=n (H2SO4)=xmol,n(Cl )=n( AgNO3)=ymol,根据电荷守恒
)=n( AgNO3)=ymol,根据电荷守恒
2x[Ba2+]+[Na+]=[Cl ],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl
],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl )。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a 。
)。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a 。
5.答案:B
[考点]本题考查了阿伏加德罗定律及其应用。
[解析]由PV=nRT可知:气体的体积在温度、压强一定时,体积与物质的量成正比;当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离,而不是分子本身体积的大小。 所以A、D错;B正确;只有标况下气体摩尔体积才近似为22.4L/mol。
4.答案:C
[解析]2 mol重水含有2NA个D2O分子,故A选项错误;1 g氢气的物质的量为mol,因此含有有NA个H2分子,B选项错误;2 mol钠在反应中失去2mol电子,因此在反应中得到1mol,故C选项正确;水为液态,22.4 L水也不是1mol,故D选项错误。
3.答案:A
[解析]解题时要注意回忆概念、分析原理注意运算公式的适用范围。B选项4.6gNO2气体中理论上含有1mol NO2分子,约6.02×1023个NO2分子,由于2NO2
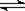 N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
2.答案:B
[解析]根据题意可以知道,铁粉完全反应且反应前后固体的质量不变,因此设参加反应的CuSO4与H2SO4的物质的量分别为x和y,则:
Fe + CuSO4 = FeSO4+Cu △m
1mol 56g
x 56 x g·mol-1
Fe + H2SO4 = FeSO4+H2↑ △m
1mol 8g
y 8 y g·mol-1
因反应前后固体的质量没有发生变化,因此第一个反应质量的减小等于第二个反应质量的增加,即56x g·mol-1=8 y g·mol-1,所以 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com