
题目列表(包括答案和解析)
11.[江苏09丰县高三模拟4月]有A、B、C、D四种元素,其中A元素和B元素的原子都有1个末成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个末成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、B两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题。
(1)A单质、B单质、化合物R的熔点大小顺序为下列的__________(填序号)
①A单质>B单质>R ②R>A单质>B单质
③B单质>R>A单质 ④A单质>R >B单质
(2)CB3分子的空间构型是___________,其固体时的晶体类型为____________。
(3)写出D原子的核外电子排布式____________________,C的氢化物比D的氢化物在水中溶解度大的多的原因__________________________。
(4)D和Fe形成一种黄色晶体FeD2,FeD2晶体中阴、阳离子数之比为_____________,
FeD2物质中具有的化学键类型为______________________________。
答案、.(1)②(1分)(2)三角锥(1分) 分子晶体(1 分)
(3)1S22S22P63S23P4(2分) NH3 与水分子形成氢键且发生化学反应(4)1:1(1分)
离子键、非极性键(或离子键、共价键)(2分)
10.[江苏09丰县高三模拟4月](12分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
答案、.(1)C<O<N (2)三角锥形
sp3 (3) N2O
N2O
(4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) [Cr(NH3)4(H2O)2]Cl3
(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
9. [09江苏模式高考化学模拟试卷(二)](8分)A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如下图所示。

请回答:
(1)上述元素的最高价氧化物的水化物中,碱性最强的是(写化学式) ;上述元素的气态氢化物中,最稳定的是(写化学式) 。
(2)上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质的分子式是 。
(3)已知D、F、G三种元素的离子均具有跟Ne相同的电子层结构,则这三种离子的半径由大到小的次序为(用相关元素的离子符号表示) > > 。
答案、. 17. (共8分,每空2分)
(1)NaOH HF
(2)N2、O2、F2、Ne
(只写对一个不给分,写出两个给1分,写错没有分)
(3)F->Na+>Mg2+
7.
 [09苏北三市联考](12分)聚合铁(简称PFS),化学式为: 。现代污水处理工艺中常利用PFS在水体中形成絮
[09苏北三市联考](12分)聚合铁(简称PFS),化学式为: 。现代污水处理工艺中常利用PFS在水体中形成絮
状物,以吸附重金属离子。
(1) ①PFS中铁显 价,铁原子的电子排布式是 。
②O元素的第一电离能 N元素的第一电离能(填“大于”或“小于”),原因是 ;水分子中氧原子的杂化轨道类型为: 。H2O与H+以配位键结合成H3O+的立体结构为 。
(2) 水在不同的温度和压力条件下可以形成11种不同结构的晶体,密度从比水轻的0.92g/cm3到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰-Ⅶ的晶体结构为一个如右上图所示的立方晶胞,每个水分子可与周围 个水分子以氢键结合,晶体中,1mol水可形成 mol氢键。
(3) 已知下列元素的电负性数据:H:2.1, O:3.5, F:4.0。 OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F-O键中共用电子对偏向F而产生的极性;②从电负性上看, 。
答案、A.(12分)物质结构与性质
(1) ①+3(1分);1s22s22p63s23p63d64s2 (2分);
②小于(1分),因为O原子和N原子的外围电子排布分别为:2s22p4 、2s22p3,N原子的p轨道半充满,相对稳定,所以第一电离能大(2分);sp3(1分) ; 三角锥形(1分)。
(2) 4 (1分); 2(1分)。
(3) 氧与氢的电负性差大于氧与氟的电负性差(2分)。
8[09江苏模式高考化学模拟试卷(二)](12分)元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 |
单质常温、常压下是气体,原子的L层有一个未成对的p电子。 |
+2价阳离子的核外电子排布与氖原子相同。 |
⑴上表中与A属于同一周期的元素是 ,写出D离子的电子排布式 。
⑵D和C形成的化合物属于 晶体。
写出C单质与水反应的化学方程式 。
⑶对元素B的单质或化合物描述正确的是 。
a、B元素的最高正价为+6
b、常温、常压下单质难溶于水
c、单质分子中含有18个电子
d、在一定条件下镁条能与单质B反应
⑷A和D量元素金属性较强的是(写元素符号) 。写出能证明该结论的一个实验事实 。
答案、. ⑴Mg 1s22s22p6
⑵离子 2F2+2H2O=4HF+O2
⑶b d(B是氧气或氮气)
⑷Na 钠与水反应比镁与反应剧烈后氢扬化钠的碱性比氢氧化镁强(合理即给分)
6.[09江苏模式高考化学模拟试卷]A物质结构与性质 由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
 Na2O+Cl2=2NaCl+O2
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
⑴ Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式 ;
⑵ CCl4分子中C原子采取 杂化成键。
⑶ COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
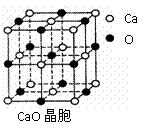
⑷ CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是 。
答案、.A.物质结构与性质
⑴ 1s22s22p63s23p63d3(2分)
⑵ sp3(2分)
⑶  (2分) c(2分)
(2分) c(2分)
⑷ 6(2分)CaO晶体中离子的电荷数大于NaCl(2分)
5.[09江苏模式高考化学模拟试卷]下列关于晶体的说法正确的组合是[D]
 ① 分子晶体中都存在共价键 ② 在晶体中只要有阳离子就一定有阴离子 ③ 金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低 ④ 离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键 ⑤ CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻 ⑥ SiO2晶体中每个硅原子与两个氧原子以共价键相结合 ⑦ 晶体中分子间作用力越大,分子越稳定 ⑧ 氯化钠熔化时离子键被破坏
① 分子晶体中都存在共价键 ② 在晶体中只要有阳离子就一定有阴离子 ③ 金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低 ④ 离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键 ⑤ CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻 ⑥ SiO2晶体中每个硅原子与两个氧原子以共价键相结合 ⑦ 晶体中分子间作用力越大,分子越稳定 ⑧ 氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
4.([盐城市2008/2009学年度高三年级摸底考试]12分)
A.为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:
(1)下列由极性键形成的极性分子是 ▲ 。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法不正确的是 ▲ 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 ▲ 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B. C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构 D.第一电离能:N<O<F
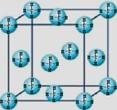 (4)甲烷晶体的晶胞结构如右图,下列有关说法正确的是 ▲ 。
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的是 ▲ 。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
3、2008届江苏省宿迁中学高三实验班化学模拟(A).[物质结构与性质]
(10分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
A |
|
|
|
|||||||||
|
|
|
B |
|
|
C |
|
|
||||||||||
|
|
|
|
|
|
|
D |
E |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素D的基态原子电子排布式 ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有__________种,
(2)D、E两元素的部分电离能数据列于下表:
|
元 素 |
D |
E |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态D2+再失去一个电子比气态E2+再失去一个电子难。对此,你的解释是 ;
(3)A的氢化物的中心原子的杂化形式为 ;C在空气中燃烧产物的分子构型为 ,该分子是 (填“极性”或“非极性”)分子,与其互为等电子体的单质的分子式为 。
(4)B单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为 。
答案、 (A)、(1)1s22s22p63s23 p63d54s2 (1分) 8 (1分)
(2) Mn2+的3d轨道电子排布为半满状态较稳定 (2分)
(3)sp3 (1分) V型(或角型)(1分)极性 (1分) O3 (1分)
(4) 12 (1分) 4 (1分)
2.(江苏省淮安中学2008~2009学年度高三12分)元素周期律是20世纪科学技术发展的重要理论依据之一。已知A、B、C、D、E五种元素都是元素周期表中前20号元素。A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水。E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族。
|
|
|
|
|
…… |
|
A |
|
|
|
B |
|
C |
D |
|
|
根据以上信息,回答下列问题:
(1)上述五种元素中电负性最大的是 。(填相关元素的元素符号)
(2)请写出D的电子排布式:
(3)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 。
(4)请写出B、C的最高价氧化物的水化物相混合反应的离子方程式:
 (5)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,
(5)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,
阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的电子式为 。
答案、.(12分)
(1)F(2分);
(2)1S22S22P63S23P4(2分)
(3)HF(2分),因为HF分子间存在氢键(2分);
 (4)Al(OH)3+OH-=AlO2-+2H2O(2分)
(4)Al(OH)3+OH-=AlO2-+2H2O(2分)
(5) (2分)。
1.[华士实验中学09江苏模式高考化学模拟试卷一](12分)
A. 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
答案、. A.(12分)
(1)C<O<N (2)三角锥形 sp3
(3) N2O
N2O
(4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) [Cr(NH3)4(H2O)2]Cl3
(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com