
题目列表(包括答案和解析)
7、某300mLKOH溶液中含有84g溶质。现欲配制1mol/LKOH溶液,应取原溶液与水的体
积比约为( )
A.1︰4 B.3︰4 C.2︰1 D.2︰3
6.某10% 的NaOH溶液,加热蒸发掉100g水后得到80mL20%的NaOH溶液,则该20%
的NaOH溶液的物质的量浓度为( )
A.6.25mol/L B.12.5mol/L C.7mol/L D.7.5mol/L
5、下列溶液中的氯离子数目与50 mL 1 mol·L-1的AlCl3溶液中氯离子数目相等的是( )
A.200 mL 1 mol·L-1的NaCl B.75 mL 2 mol·L-1的NH4Cl
C.150 mL 3 mol·L-1的KCl D.75 mL 2 mol·L-1的CaCl2
4、下列溶液中氯离子浓度最大的是( )
A.10mL0.1mol·L-1的AlC13溶液 B.20mL0.2mo1·L-1的CaC12溶液
C.30mL0.5mo1·L-1的KClO3溶液 D.100mL0.25mo1·L-1的NaC1溶液
3、将aL标准状况下氯化氢气体溶于水中制得100mL盐酸,则该盐酸的物质的量浓度为( )
A.a/22400mol/L B.a/2.24mol/L C.a/22.4mol/L D.a/11.2mol/L
2、200mL密度为1.20g/mL、质量分数为31%的硝酸的物质的量浓度为( )
A.1mol/L B.3mol/L C.6mol/L D.7.2mol/L
1、16g氢氧化钠溶于一定量水中得到200mL溶液,则该溶液的物质的量浓度为( )
A.1mol/L B.2mol/L C.3mol/L D.3.6mol/L
1.[南京市2009届高三化学考前专题]四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
⑴写出B原子的电子排布式 ▲ 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 ▲ (填“高”或“低”),其原因是 ▲ 。
⑶D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 ▲ (填“高”或“低”),其原因是 ▲ 。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ▲ ,简要描述该配合物中化学键的成键情况 ▲ 。
 ⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
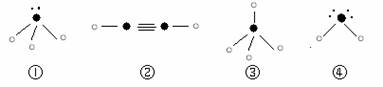
则在以上分子中,中心原子采用sp3杂化形成化学键的是 ▲ (填写序号);在②的分子中有 ▲ 个σ键和 ▲ 个π键。
3.[盐城市伍佑中学2009年江苏高考化学押题卷](A)[物质结构与性质]等电子体原理是指两个或两个以上的分子(或离子),它们的原子数相同,分子(或离子)中价电子数也相同,这些分子(或离子)常具有相似的电子结构,相似的几何构型,而且有时在性质上也有许多相似之处。
(1)SiO32-、SO32-、NO3-三种离子是等电子体,三种离子的几何构型为__________,其中Si、S、N三种基态原子的第一电离能大小关系为_____________________。
(2)C2O42-和 是等电子体,C2O42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色,Mn原子在元素同期表中的位置是__________,外围电子构型为__________。
(3)二原子14电子的等电子体共同特点是物质中都具有共价叁键,请举出相应的3个例子____________________(可以是分子或离子)。每个分子或离子中含_____个σ键,______个π键。
(4)过去生产上常以SiO2为催化剂的载体,它和近十几年来应用日广的AlPO4是等电子体,在AlPO4中 P为 配位氧。SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞,则一个硅的晶胞中有________个Si原子。再在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有_______个Si原子,______个O原子。
1.[南京市2009届高三第一次调研测试]下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
|
Z |
|
|
|
|
|||||||||||||
|
|
|
M |
L |
Q |
R |
|
|
||||||||||
|
D |
A |
|
|
T |
X |
Y |
|
||||||||||
|
E |
|
|
|
|
|
|
|
|
J |
|
|
|
|
|
|
|
|
(1)Y分别与D、E形成的化合物中熔点较高是 ▲ (用化学式表示);T、X、Y原子的第一电离能由小到大的顺序是 ▲ (用元素符号表示)。
(2)LX2分子的电子式是 ▲ ,XY2分子是 ▲ (填“极性分子”或“非极性分子”);QY3分子中Q采用 ▲ 杂化。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则J原子的核外电子排布式是 ▲ (基态);与配体粒子互为等电子体的离子是 ▲ ;J(LR)4固态时属于 ▲ 晶体(填晶体类型)
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多同分异构体(其中Q以三个单键与其它原子相连),写出其中沸点最低的物质结构简式 ▲ 。
(5)A与M组成的一种化AM2,刷新了金属化合物超导 温度的最高记录。右图中所示的是该化合物的晶体结构单元。图中上下底面中心“Δ”处的原子是 ▲ (填元素符号)。


 2.[盐城市伍佑中学2009年江苏高考化学押题卷]二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是[B]
2.[盐城市伍佑中学2009年江苏高考化学押题卷]二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是[B]
A.S2Cl2的电子式为
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:
2S2Cl2+2H2O=SO2↑+3S↓+4HCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com