
题目列表(包括答案和解析)
9. 在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g )+Q Q> 0。
2NH3(g )+Q Q> 0。
反应中NH3的物质的量浓度的变化的情况如图:

(1)根据图,计算从反应开始到平衡时,平均反应速率v(NH3)为____ _。
(2)该反应的化学平衡常数表达式K = 。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡_________________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
8. (1)Zn2++4OH-=[Zn(OH)4]2- (2分
(2)10-17 (2分
 (3)(8.0 ,
12.0) (2分
(3)(8.0 ,
12.0) (2分
(4) 1.8 (2分
(5)a b c d (2分漏1个扣一分扣完为止)
8. 如图横坐标为溶液的pH值,纵坐标为Zn2+ 离子或Zn(OH)42-离子(配离子)物质的量浓度的对数,回答下列问题。

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为 。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)= 。
(3)某废液中含Zn2+ 离子,为提取Zn2+ 离子可以控制溶液中pH值的范围是 。
(4)往1L 1.00 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH mol (精确到小数点后2位)。
(5)25℃时,PbCl2固体在盐酸中的溶解度如下:
|
c(HCl)/ (mol·L-1) |
0.50 |
1.00 |
2.04 |
 2.90 2.90 |
4.02 |
5.16 |
5.78 |
|
103 c(PbCl2)/ (mol·L-1) |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是 。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(配离子)
D.PbCl2固体可溶于饱和食盐水
7.(1)0.075mol/L·min(1分)
(2)放热, CO(g)+2H2(g) → CH3OH(g) +91KJ, 不能(各1分,共3分)
(3)K = ,减小;(各1分,共2分) (4)c(2分)
7. 工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。

(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=_________;
(2) 图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是_________(选填“吸热”或“放热”)反应,写出反应的热化学方程式____________________________;选择适宜的催化剂, ______(填“能”或“不能”)改变该反应的反应热;
 (3) 该反应平衡常数K的表达式为______________,温度升高,平衡常数K_________(填“增大”、“不变”或“减小”);
(3) 该反应平衡常数K的表达式为______________,温度升高,平衡常数K_________(填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使 增大的有______。
a.升高温度; b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂
6. ①H2C2O4+OH―=HC2O4―+H2O (1分)
②c(HC2O4―) >c(H+)>c(C2O42―)>c(H2C2O4) (2分)
③a>b (2分)
④变小(2分);
因为溶液中存在如下平衡C2O42-+H2O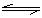 HC2O4-+OH―,当增大c(OH―)时,平衡向逆方向移动,n(C2O42-)的值变大,而n(K+)的值不变,故n(K+) / n(C2O42-)的值变小。(2分)
HC2O4-+OH―,当增大c(OH―)时,平衡向逆方向移动,n(C2O42-)的值变大,而n(K+)的值不变,故n(K+) / n(C2O42-)的值变小。(2分)
6. 草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向10mL 0.01mol•L―1的H2C2O4溶液滴加0.01mol•L―1KOH溶液V(mL),回答下列问题。
①当V<10mL时,反应的离子方程式为 。
②当V=10mL时,溶液中HC2O4―、C2O42―、H2C2O4、H+的浓度从大到小的顺序为 。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42―)+c(HC2O4―);
当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42―)+c(HC2O4―)+c(H2C2O4);则a b(填“<”,“=”或“>”)。
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+) / n(C2O42-)的值将 (填“变大”,“变小”,“不变”),原因是 。
5. ⑴0.02 mol/L; c ( B) ·[c( C)]2/ [c( A)]3 ⑵ 增大 (3)0.004mol/L·s ;
 (4)a b (2分) (5) 3A (g)
(4)a b (2分) (5) 3A (g) 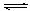 2C(g) + B(g)-100akJ
2C(g) + B(g)-100akJ
5. 向某密闭容器中加人 0.15mol/LA 、 0.05mol/LC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0 时c( B) 未画出, t1时增大到0.05mol/L]。乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
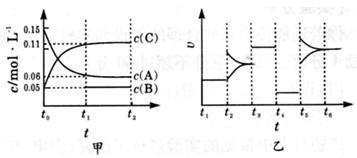
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为___mol/L;
该反应的平衡常数表达式为K= 。
 (2)若t5时改变的条件是升温,此时v(正) > v(逆), 平衡常数K的值将__(选填“增大”、“减小”或“不变”)。
(2)若t5时改变的条件是升温,此时v(正) > v(逆), 平衡常数K的值将__(选填“增大”、“减小”或“不变”)。
(3)若 t1= 15 s ,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=____mol/L· s。
(4) t3 时改变的某一反应条件可能是 (选填序号)。
a使用催化剂 b增大压强 c增大反应物浓度
(5)若A 的物质的量减少 0 . 03 mol时,容器与外界的热交换总量为 akJ ,写出该反应的热化学方程式___________________。
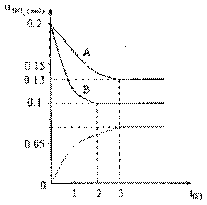
4. 在容积为VK的密闭容器中发生2NO2
在容积为VK的密闭容器中发生2NO2 2NO+O2的反应。反应过程中NO2的物质的量 随时间变化的状况如图所示。(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是( )
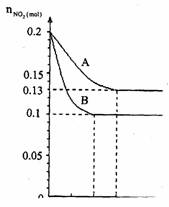
A.有、无催化剂
B.温度不同
C.压强不同
D.V值不同
(2)写出该反应的化学平衡常数K的表
达式 ,并比较
K800℃ K850℃(填>、<或=)。
(3)在图上作出在A条件下NO的变化曲线,并求算在B条件下从反应开始至达到平衡,氧气的反应速率VO2= 。
(4)不能说明该反应已达到平衡状态的是 ( )
A.V正(NO2)=V逆(NO) B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
 4.
答案.(1)B
4.
答案.(1)B
 (2)
(2) <
<
(3)
(4)BD
第(4)题2分,VO2 2分,
其余各1分,共8分。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com