
题目列表(包括答案和解析)
20. “嫦娥一号”登月成功,实现了中国人“奔月”的梦想。
“嫦娥一号”登月成功,实现了中国人“奔月”的梦想。
(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是
;
。(请写两条)
(2)下列是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热学化方程式:H2(g)+1/2O2(g) H2O(l);△H=-285.8kJ/mol
C(g)+O2(g)=CO2(g);△H=-393.5kJ/mol
C8H18(l)+25/2O2(g) 8CO2(g)+9H2O(l);△H=-5518kJ/mol
CH4(g)+2O2(g) CO2(g)+2H2O(l);△H=890.3kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是 ,通过计算说明等质量的氢气和碳燃烧时产生热量的比是 (保留1位小数)。
(3)已知:H2(g)=H2(l);△H=-0.92kJ/mol O2(g) O2(l);△H=-6.84kJ/mol
H2O(l)=H2O(g);△H=44.0kJ/mol
请写出液氢和液氧生成气态水的热化学方程式: 。
如果此次嫦娥一号所携带的燃料为45吨,液氢、液氧恰好完全反应生成气态水,总共释放能量 kJ(保留3位有效数字)。
(4)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应式为:负极: ; 正极: ;
总反应式: 。
(5)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol·L-1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。(写出计算过程)
①若溶液体积仍为100mL,此时溶液的pH为多少?(不考虑硫酸铜水解)
②此时氢氧燃料电池中消耗H2和O2的质量各是多少?(保留2位小数)
19.答案:(1)10-4:(1分) (2)Ba2++HCO3-+ OH-==BaCO3↓+H2O(2分)
(3)负(1分),CH4+10OH--8e-==CO32-+7H2O (2分), (4)t0~t1(2分) 25% 2/3
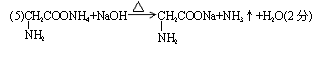
19.A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)将BA4,D2分别通入插在碱溶液中的两个电极形成燃料电池,则通BA4的一极为 极,电极反应式为 。
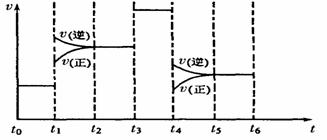
(4)化学反应3A2(g)+C2(g) 2CA3(g)。当反应达到 平衡时不 断改变条件(不改变A2、C2和CA3的量),图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
。温度为T℃时,将4amolA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则平衡混合气中C2的体积分数为
,平衡时压强为起始压强的
倍。
2CA3(g)。当反应达到 平衡时不 断改变条件(不改变A2、C2和CA3的量),图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
。温度为T℃时,将4amolA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则平衡混合气中C2的体积分数为
,平衡时压强为起始压强的
倍。
(5)化合物A8B2C2D2与烧碱溶液共热,产生使红石蕊试纸变蓝的气体,写出该反应的化学方程式: 。
18.(1)在实验1,反应在0至20分钟时间内平均速率为 0.0165 mol/(L·min)。
(2)在实验2,A的初始浓度c2= 1.0 mol/L,反应在 20分钟内就达到平衡,
可推测实验2中还隐含的条件是 使用了催化剂 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时
v3 > v1(填>、=、<=)且c3 = 1.2 mol/L。
(4)比较实验4和实验1,可推测该反应是 吸热 反应(选填吸热、放热)。
理由是 温度升高,反应物A的平衡浓度降低,说明正反应为吸热反应 。
(5) 800℃时,反应2A  B+D的平衡常数= 0.25 ,
其他条件不变, 达到平衡时
B+D的平衡常数= 0.25 ,
其他条件不变, 达到平衡时
A的浓度为 0.5 mol/L, B的转化率= 50% 。
18.某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
浓度(mol/L) |
时间(min) |
|||||||
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
|
1 |
温 度 |
8000C |
1.0 |
0.80 |
O.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8000C |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
|
3 |
8000C |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
|
4 |
8200C |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在0至20分钟时间内平均速率为_____mol/(L·min)。
 (2)在实验2,A的初始浓度c2=____________mol/L,反应在
20分钟内就达到平衡,可推测实验2中还隐含的条件是___________。
(2)在实验2,A的初始浓度c2=____________mol/L,反应在
20分钟内就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,且c3=_______mol/L。
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
理由是____________________________________________
(5) 800℃时,反应2A  B+D的平衡常数=
, 其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L,
B+D的平衡常数=
, 其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L,
B的转化率= .
17.(1)Zn+2OH--2e-=Zn(OH) 2(2分)。
(2)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大
(3)①MnOOH、C粉(2分)
②除去Zn(OH) 2和Fe(OH)3(1分)
③制备皓矾、回收金属锌等
17.请仔细观察两种电池的构造示意图,回答下列问题:
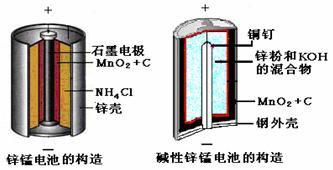
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的
电极反应式: 。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率
的因素分析其原因是
。
(3)某工厂回收废旧锌锰电池,其工艺流程如下:




已知:生成氢氧化物的pH如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
8.0 |
9.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2 。
②第一次加入H2O2后,调节pH=8.0。目的是
。
③试列举滤液4的应用实例(2种)
。
16. (1)N2H4+H2O NH2NH3+(N2H5+)+OH- (2分)(NH2NH3++
H2O
NH2NH3+(N2H5+)+OH- (2分)(NH2NH3++
H2O NH3NH32++OH- )
NH3NH32++OH- )
(2)N2H4 CO(NH2)2+ NaClO+ 2NaOH = N2H4+NaCl+Na2CO3 +H2O (2分)
(3)N2H4(l)+O2(l)=N2(g)+2H2O(l) ΔH=-621.23 kJ·mol-1
16. 北京时间2008年2月21日上午11时26分,美国用导弹击毁了失控的卫星。美方称,卫星坠落地面时,燃料罐中装有的约453 kg联氨(N2H4),可能发生泄漏,造成伤害。
(1)联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
 (2)联氨(N2H4)是航天飞船常用的高能燃料。联氨可用氨和次氯酸钠按一定物质的量之比混合反应生成联氨、氯化钠和水;该反应的氧化产物是
。也可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式
。
(2)联氨(N2H4)是航天飞船常用的高能燃料。联氨可用氨和次氯酸钠按一定物质的量之比混合反应生成联氨、氯化钠和水;该反应的氧化产物是
。也可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式
。
(3)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量;
 H2O(l)=H2O (g) DH=+44 kJ·mol-1 2H2O2(l)=2H2O(l)+
O2(g) DH=–196.4 kJ·mol-1
H2O(l)=H2O (g) DH=+44 kJ·mol-1 2H2O2(l)=2H2O(l)+
O2(g) DH=–196.4 kJ·mol-1
则写出表示联氨燃烧热的热化学方程式为 。
15.(1)溶液显色所需要的时间;(2)①2NO +2CO===N2+CO2 ;NO ②-1160kJ/mol
(3)①该项实验研究只能提高化学反应速率,不能使化学平衡移动,因而其原料的利用率不可能大大提高;②6g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com