
题目列表(包括答案和解析)
30.(2009·理综北京卷,9,)已知H2(g)+I2(g) 2HI(g);DH<0。有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
( )
2HI(g);DH<0。有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
( )
A.甲、乙提高相同温度
B.甲中加入0.1 mol He,乙不改变
C.甲降低温度,乙不变
D.甲增加0.1 mol H2,乙增加0.1 mol I2
29.(2009·广东卷,7)难挥发性二硫化钽(TaS2)可采用如下装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。其反应为:TaS2(s)+2I2(g)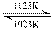 TaI4(g)+S2(g),下列说法正确的是( )
TaI4(g)+S2(g),下列说法正确的是( )

A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
28.(2009·理综重庆卷,13)各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )

27.(2009·理综天津卷,5)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力。CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K = 220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO,37 ℃时,该反应的平衡常数K = 220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数K =
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02 时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
26.(2009·理综四川卷,13)在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g);DH = Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g);DH = Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
下列说法正确的是 ( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
25.(2009·理综全国卷I,13,)下图表示反应X(g) 4Y(g)+Z(g),DH<0,在某温度时X的浓度随时间变化的曲线:
4Y(g)+Z(g),DH<0,在某温度时X的浓度随时间变化的曲线:
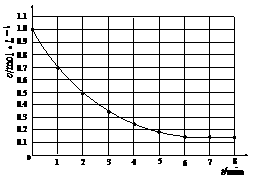
下列有关该反应的描述正确的是( )
A.第6 min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v (正)和v (逆)将以同样倍数减小
24.(2009·江苏化学卷,14)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3- (aq),某I2、KI混合溶液中,I3- 的物质的量浓度c(I3- )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
I3- (aq),某I2、KI混合溶液中,I3- 的物质的量浓度c(I3- )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )

A.反应I2(aq)+I-(aq) = I3- (aq)的DH>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v (正)>v (逆)
D.状态A与状态B相比,状态A的c(I2)大
23.(2009·理综安徽卷,11)汽车尾气净化中的一个反应如下:
NO(g)+CO(g)
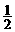 N2(g)+CO2(g);DH =-373.4 kJ·mol-1
N2(g)+CO2(g);DH =-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是 ( )

22.(2009·海南化学卷,4,)在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: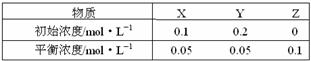
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
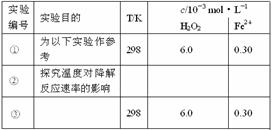
21.(2009·理综安徽卷,28)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
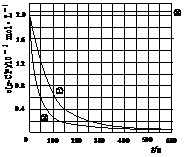
[数据处理]实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应在50 s-150 s内的反应速率:
v (p-CP) = mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
。
(4)实验③得出的结论是:pH等于10时, 。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
____________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com