
题目列表(包括答案和解析)
2.该反应为吸热反应,所以反应物的总能量要低于生成物的总能量。
(2)请提出可提高其反应速率且增大NH3生成量的建议:升高温度,增大反应物N2的浓度,不断移出生成物脱离反应体系。
解释:该反应正反应是吸热反应,升高温度,使化学平衡向正反应方向移动,从而增大NH3生成量,升高温度也能提高反应速率;增大反应N2浓度,加快反应速率,并使化学平衡向右移动;不断移出生成物脱离反应体系,使平衡向右移动,增大NH3生成量。
(3)①该条件下N2的平衡转化率:66.7%
②该条件下反应2NH3(g) ==== N2(g) +3H2(g)的平衡常数为0.005
解释:由三行式法计算可知,起始时,c(N2)=0.3mol/l.平衡时,c(N2)=0.1mol/l; c(H2)=0.2mol/l; c(NH3)=0.4mol/l 。
①所以N2的平衡转化率=(0.3-0.1)/0.3*100%=66.7%
②反应2NH3(g) ==== N2(g) +3H2(g)的平衡常数
K= c(N2)* c(H2)3/ c(NH3)2=0.005
1.催化剂可降低反应的活化能,但对这各反应前后能量变化并不产生任何影响。
14.[解析](1)画图略,
要点:
13.答案:(1)①800L·mol-1 ②=
(2)1.60NA(或1.6NA) 173.4
(3)MFe2O+SO2→MFe2O4+S
 [解析](1) 2SO2 + O2 2SO3
[解析](1) 2SO2 + O2 2SO3
起始浓度 
 0
0
(mol·L-1)
平衡浓度
(mol·L-1) 0.04 0.02 0.16
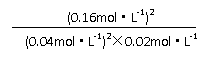
K= =800L·mol-1
②平衡状态由A变到B时,条件的改变是增大压强,温度没有变化,所以平衡常数不变,
K(A)=K(B)。
(2)将两热化学方程式相加得
2CH4(g)+4NO2(g)==2N2(g)+2CO2(g)+4H2O(g);
△H=-1 734kJ·mol-1
可以看出2×22.4L CH4被氧化转移电子总数为16NA,放出热量1 734kJ。4.48L转移电子总数为1.6NA,放出热量173.4kJ。
(3)劳动MFe2O2是由MFe2O4经高温还原而得,所以它与SO2反应时作还原剂,SO2为氧化剂,则可以写出化学方程式
MFe2O2+SO2→MFe2O4+S。
12.(共10分)
[命题意图]考查学生对化学反应可逆性、化学平衡、化学平衡常数和影响化学平衡的外界条件的了解;考查学生对盐类的水解、常见非金属元素硫及其重要化合物的主要性质及其对环境质量影响的了解;考查学生计算平衡常数和平衡转化率的能力以及学生对化学平衡和元素化合物知识的综合应用及知识迁多能力。
 (1)解:
2SO2 +O2(g)
2SO3(g)
(1)解:
2SO2 +O2(g)
2SO3(g)
起始浓度/mol·L-1 0.050 0.030 0
平衡浓度/mol·L-1 0.050-0.040 0.030-0.040÷2 0.040
=0.010 =0.010
所以,

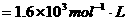 (不带单位计算也得分)
(不带单位计算也得分)
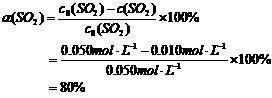 (2)B C
(2)B C
(3)SO2+H2O+Na2SO3 2NaHSO3
(4)抑制Fe3+与Fe2+的水解、防止Fe2+被氧化成Fe3+
11.答案:D
 [解析]X + 2Y
2Z
[解析]X + 2Y
2Z
起始 n mol n mol 0 mol
转化 x 2x 2x
平衡时n – x n – 2x 2x
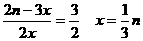 mol。
mol。
所以Y的转化率为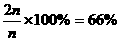 。
。
10.答案:C
[解析] 根据题意
 2HI(g) H2(g)+I2(g)
2HI(g) H2(g)+I2(g)
平衡浓度:4mol·L-1 0.5mol·L-1
起始浓度:c(HI)=平衡量+变化量=4mol·L-1+0.5mol·L-1×2=5mol·L-1
则c(NH3)=c(HI)起始浓度=5mol·L-1
根据平衡常数定义:K=c(NH3)·c(HI)=5mol·L-1·4mol·L-1=20,故C项正确。
9.答案: A
[解析] 解法1 合成氨反应是反应后气体体积减小的反应。按正常思路利用平衡计算方法。设N2、H2起始的物质的量分别为x、y,N2转化的物质的量为z,得出
 N2 + 3H2 2NH3
N2 + 3H2 2NH3
起始物质的量 x y 0
转化物质的量 z 3z 2z
平衡物质的量 (x – z ) (y – 3z ) 2z
平衡时总的物质的量为
(x–z )+(y–3z )+2z = x + y–2z
即生成氨气的物质的量就是气体总的减少的物质的量。
根据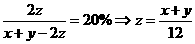
得体积缩小的百分率为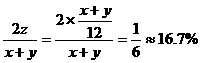
解法2 设平衡时混合气体的体积为V,则氨气为20%V,
 N2 + 3H2 2NH3 体积减少2
N2 + 3H2 2NH3 体积减少2
20%V 20%V
则反应前N2和H2体积为V+20%V=120%C=1.2V
 。
。
8.答案:A
[解析]因H2和Br2的反应为一个放热反应,所以,绝热条件下进行反应相当于对于平衡体系加热升温,平衡向左移动,即a>b。
7.答案:(1)放热 (2分)
(2)减小 根据勒夏特列原理,升高温度有利于反应向吸热方向移动,因而该反应中A的转化率减小 (2分)
(3)没有 催化剂只能改变化学反应的速率和途径,不能改变化学反应的始态和终态的能量,因此对反应热没有影响 (2分)
(4)减小 减小 (2分)
[解析]由图可以看出,反应物的总能量高于生成物的总能量,故该反应是放热反应。催化剂是通过降低活化能(E)提高活化分子的百分含量来加快化学反应速率的,但不影响化学平衡状态(或化学平衡不移动)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com