
题目列表(包括答案和解析)
34.答案: (1)BC。 (2)-1224.96
(3)根据题意知平衡时:c(N2O4) = 0.0120 mol·L-1;c(NO2) = 0.0300 mol·L-1
K =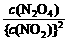 =
=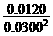 = 13.3
答:平衡常数为13.3。
= 13.3
答:平衡常数为13.3。
(4)由(3)可知,在17 ℃、1.01×105 Pa达到平衡时,1.00 L混合气体中:
n(N2O4) = c(N2O4)×V = 0.0120 mol·L-1×1.00 L = 0.0120 mol。
n(NO2) = c(NO2)×V = 0.0300 mol·L-1×1.00 L = 0.0300 mol。
则n(NO2)总 = n(NO2)+2×n(N2O4) = 0.0540 mol
由Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O可得
m(Cu) = 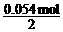 ×64 g·mol-1 = 1.73
g
×64 g·mol-1 = 1.73
g
答:理论上至少需消耗Cu 1.73 g.
[解析](1)由于正反应是放热反应,降低温度,平衡向正反应方向移动,提高NO2的转化率。若增加NO2的浓度,可以利用“虚拟容器法”判断:将加入的NO2先建立一下与原平衡等效的平衡,再合并,相当于体积减小,压强增大,平衡向正反应移动,NO2转化率提高。
(2)1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量,则2 mol即64 g N2H4(l)反应放出热量1224.96 kJ。
|

|
版权所有:()
版权所有:()
33.答案: (1)<。 (2) 1.88×10-4 mol/(L·s)。 (3)5000。 (4)C、D。
(5)①II:280、1.20×10-3、5.80×10-3
III:1.2×10-3 、5.80×10-3。
② 。
。
[解析](1)自发反应,通常为放热反应,即DH小于0。
(2)v(N2) =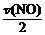 =
=  = 1.88×10-4 mol/(L·s)。
= 1.88×10-4 mol/(L·s)。
(3)从中数据知,在第4s、5s时为平衡状态:
2NO+2CO = 2CO2+N2
c(始)/(×10-4 mol·L-1) 10 36 0 0
c(转)/(×10-4 mol·L-1) 9 9 9 4.5
c(平)/(×10-4 mol·L-1) 1 27 9 4.5
K =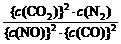 =
=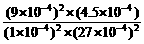 = 5000。
= 5000。
(4)催化剂不影响平衡的移动,A项错。该反应放热,故降温平衡正向移动,NO转化率增大,B项错,C项正确。缩小体积,即增大压强,平衡向体积减小的方向运动,即正向移动,D项正确。
(5)本题为实验探究题,目的是研究温度和催化剂的比表面积对反应速率的影响,所以在实验时应保持NO、CO的初始浓度不变,让温度、比表面积其中一个量变化,因此可确定II中温度为280 ℃。
绘图时,要注意达平衡的时间、平衡浓度的相对大小:II与I温度相同,平衡不移动,平衡浓度相同,但催化剂比表面积增大,达平衡时间短;III与II的催化剂比表面积相同,温度升高,不仅达平衡时间缩短,也也平衡向左移动,使NO的平衡浓度也增大。实质I、II研究是催化剂的比表面积对速率的影响,II、III研究是温度对速率的影响。
32.答案: (1) 。
。
(2)X(g)+2Y(g) 2Z(g)
2Z(g)
(3)v (Z) = = 0.083 mol/(L·min)
= 0.083 mol/(L·min)
(4)45%。
(5)升高温度; 加入催化剂; 增大压强。
[解析]有关化学平衡的计算,大多情况下,找出三种浓度(或量)是进行各种计算的前提。
根据题意,有:aX + bY  cZ
cZ
n(始)/mol 1.00 1.00 0
n(转)/mol 0.45 0.9 0.9
n(平)/mol 0.55 0.1 0.9
(2)根据转化的物质的量比(1:2:2)等于计量数比,可得相应的化学方程式:X+2Y 2Z。
2Z。
(4)从三种量可知:a(X) = 0.45 mol/1.00 mol = 45%。
(5)从达平衡的时间长短来考虑,通常是:催化剂<温度<浓度(或压强),所以先达平衡的2应该是催化剂,1可能是温度、3可能是压强。再从平衡移动的角度考虑,来进一步验证:催化剂对平衡没影响,所以以2为参照对象;加压,平衡右移,n(Z)增大(比2大),所以确定3是压强的影响;升温,因正向放热,使平衡左移,n(Z)减小(比2小),所以确定1是温度的影响。
31.答案: BD
[解析]其全过程应该如图D:开始时,主反应向右,NO2%减小;达平衡时,NO2%最小;接着升温,主反应向左,NO2%增大。所以D图正确。
但因起始温度不同,反应相同时间后,有可能已达到平衡状态。此时,测定体系中NO2%与升温的关系,就出现了图D中的右半部,所以B图也正确。
30.答案:C
[解析]在相同条件下,甲、乙容器中达平衡时是等效平衡,欲使HI的平衡浓度甲>乙,能使用的方法有:①变温:若二者都变化同等温度,必仍是等效平衡(A项错),可让甲降温使平衡右移(C项对)。②变压(不改变物料):压缩甲,虽平衡不移动,但c(HI)必增大,但该题是容器固定,所以此法不通。③改变物料:B项中,充入惰性气体,因容器固定,对各物的浓度没影响,对平衡也没影响,此法不通;若只甲中增加物料(任意一种物质),不论平衡向哪方移动,平衡时c(HI)必比原平衡大,可达目的;但D项中,甲、乙均增加物料,且二者增量相同,又因反应中H2与I2的系数相同,所以甲与乙增量的功效相同,新平衡后的c(HI)仍相同,不符题意。
29.答案:C
[解析]高温区,向右反应,生成的TaI4气体流向低温区;低温区,向左反应,TaI4气体生成TaS2固体;一段时间后,杂质留在高温区,TaS2在低温区,从而达到分离效果。不同温度下反应的方向不同,TaI4的量与温度高低有关并非保持不变,A错误。因为是在同一密闭系统中,从质量守恒定律可知:I2的量不可能不断减少,而是充当一个“搬运工”的角色,将TaS2从高温区转移到低温区,B错误、C正确。平衡常数与TaI4和S2的浓度乘积成正比,D错误。
28.答案: D
[解析]结合图像考查外界条件改变对各可逆反应平衡的影响。A中加入CH3COONa,溶液中CH3COO-离子增多,平衡逆向移动,c(H+)减小,pH增大;B中实际反应为Fe3++3SCN- = Fe(SCN)3,故改变KCl的浓度对平衡几乎无影响;C中由于是恒温恒压,通入Ar会导致反应物浓度减小,平衡会逆向移动;D中反应正向为吸热反应,故升温可以使平衡正向移动,即使CH3OCH3的转化率增大。故答案是D。
27.答案:C
[解析]据平衡移动原理,增大反应物(CO)的浓度,平衡右移,增大生成物(O2)的浓度,平衡左移,所以B项、D项正确。C项,据题意知:K = 220 = ,人智力受损时
,人智力受损时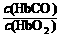 = 0.02,此时
= 0.02,此时 = 0.02/220 = 9×10-5,C项错。
= 0.02/220 = 9×10-5,C项错。
26.答案: C
[解析]本题考查化学平衡移动的有关知识。固定温度条件(比如取100 ℃)讨论气体体积变化对Y浓度的影响:当体积扩大1倍时(压强减小),若平衡不移动则c(Y) = 0.5 mol/L,而实际上为0.75 mol/L,大于0.5 mol/L,这表明平衡是向右移动的,即减小压强平衡右移,这说明正反应是一个体积扩大的反应,m<n,A错、C正确。固定体积(如1体积)讨论温度变化对Y浓度的影响,知温度越高,Y浓度越大,说明升高温度平衡正移,正反应是吸热反应,B、D错。
[解法指导]本题所给数据中,有二个影响Y浓度的条件,分析时可固定一个条件,讨论另一个条件对Y浓度的影响--定一讨论法。
25.答案:B
[解析]A项,6min时反应达平衡,但反应未停止,故错;B项,X的平衡转化率为:(1-0.15)/1 = 0.85,正确。C项,DH<0,正反应方向为放热,升温,平衡逆向移动,X的转化率减小,故C项错;D项,温度变化对正、逆反应速率的影响都不是同等倍数变化,故错。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com