
题目列表(包括答案和解析)
19. 答案: (1)  (2)Al3++4OH- = AlO2-
+2H2O (3)①
(2)Al3++4OH- = AlO2-
+2H2O (3)① ;三角锥形。 ②AlN。(4)4Al+3TiO2+3C
;三角锥形。 ②AlN。(4)4Al+3TiO2+3C 2Al2O3+3TiC
2Al2O3+3TiC
[解析]本题结合元素周期表等考查元素和化合物的有关性质。根据X的性质可以确定X为Al,其硫酸盐为Al2(SO4)3,它们与过量的NaOH反应生成的是偏铝酸盐,据此可以写出离子反应;由于Al是第三周期元素,则Y是第二周期元素,根据Z中含有10个电子和Z能与H2O2反应,则Z有较强的还原性,Z应该是NH3,Y是N,那么A是AlN。由于生成的化合物中均含有两种元素且都是新型陶瓷材料,则生成的分别是Al2O3和TiC,并根据氧化还原反应中转移电子守恒可以写出化学反应。
[思维拓展]解答这类试题要抓住题中的有关信息,如短周期中只有单质Al既能与酸又能与碱反应,且均为短周期元素,那么Y应为第二周期元素,Z又能与H2O2发生反应,说明Z具有还原性,根据Z是10电子,可以确定Y,有些考生对无机非金属材料等内容不够重视,也会导致不会书写(4)的化学反应。因此,复习时不要顾此失彼,做到全面复习;解答这类问题时还要从多角度抓住不同信息。
18.答案: (1)Na>Al>O (2)HNO3>H2CO3>H2SiO3
(3) 或
或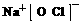 。 (4)a b。
。 (4)a b。
(5)Al3++3NH3·H2O = Al(OH)3↓+3NH4+
2Al2O3(熔融)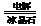 4Al+3O2↑ 溶液的pH等于7(或“中性”)。
4Al+3O2↑ 溶液的pH等于7(或“中性”)。
[解析](3)四种元素分别为H、O、Na和Cl,含离子键必有Na+,含极性共价键则应有两种非金属组成。(4)符合题意的物质应是H2O2,它在MnO2、FeCl3等催化剂作用下能发生分解反应。(5)⑥为Al,则有:Z[Al(OH)3] N(Al2O3)→Al;“M是仅含非金属的盐”,应为铵盐,即X+Y→Z[Al(OH)3]+M(NH4+ 盐),据复分解反应规律知“X和Y”为“Al3+(盐)+碱(NH3·H2O)”,但X、Y谁为NH3·H2O,还须通过下面的题给条件来确定:“为使M(NH4+ 盐)溶液中NH4+ 、酸根离子的浓度相等,应向溶液中加入一定量的Y溶液至_______”,这说明Y为NH3·H2O(NH4+ 盐溶液中加NH3·H2O可从酸性变中性)、X(铝盐)的酸根为-1价,即X为AlCl3或Al(NO3)3。铵盐溶液中加NH3·H2O可从酸性变中性的原理是:据电荷守恒:c(NH4+ )+c(H+) = c(Cl-)+c(OH-),若c(NH4+ ) = c(Cl-),必有c(H+) = c(OH-),即中性。
N(Al2O3)→Al;“M是仅含非金属的盐”,应为铵盐,即X+Y→Z[Al(OH)3]+M(NH4+ 盐),据复分解反应规律知“X和Y”为“Al3+(盐)+碱(NH3·H2O)”,但X、Y谁为NH3·H2O,还须通过下面的题给条件来确定:“为使M(NH4+ 盐)溶液中NH4+ 、酸根离子的浓度相等,应向溶液中加入一定量的Y溶液至_______”,这说明Y为NH3·H2O(NH4+ 盐溶液中加NH3·H2O可从酸性变中性)、X(铝盐)的酸根为-1价,即X为AlCl3或Al(NO3)3。铵盐溶液中加NH3·H2O可从酸性变中性的原理是:据电荷守恒:c(NH4+ )+c(H+) = c(Cl-)+c(OH-),若c(NH4+ ) = c(Cl-),必有c(H+) = c(OH-),即中性。
17.答案: (1) (2)弱于。
(2)弱于。
(3)S+2H2SO4(浓) 3SO2↑+2H2O。
3SO2↑+2H2O。
(4)2H2O2 2H2O+O2↑(或其他合理答案)。
2H2O+O2↑(或其他合理答案)。
(5)NaNO2。
(6)(3a-4b) KJ/mol
[解析]本题考查无机物的性质,涉及化学用语、方程式书写、氧化还原反应以及热化学的知识。
T所处的周期序数与主族序数相等,T不可能是Mg,只能是Al,继而推出Q为C,R为N,W为S。
(2)S、C最高价含氧酸为酸性是硫酸>碳酸,故非金属性S强于C。
(3)S与H2SO4发生归中反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价看,只能是SO2。
(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应。
(5)N中相对分子质量最小的氧化物为NO,2NO+O2 = 2NO2,得混合物NO(1 L)-NO2(1 L),再用NaOH吸收,从氧化还原角度看,应发生归中反应:NO+NO2+2NaOH = 2NaNO3+H2O。
(6)C+O2 CO2
DH =-a kJ/mol①,4Al+3O2 = 2Al2O3
DH =-4b kJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al+3CO2
CO2
DH =-a kJ/mol①,4Al+3O2 = 2Al2O3
DH =-4b kJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al+3CO2 3C+2Al2O3,此反应的DH为可由②-①×3得,DH =-4b-(-3a) = (3a-4b) kJ/mol。
3C+2Al2O3,此反应的DH为可由②-①×3得,DH =-4b-(-3a) = (3a-4b) kJ/mol。
16.答案: (1)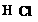 非极性。 (2)S>Cl>F; 三 IA。
(3)a。(4)①不一定容易 ②除F2外,键长增长,键能减小(合理即给分)。
非极性。 (2)S>Cl>F; 三 IA。
(3)a。(4)①不一定容易 ②除F2外,键长增长,键能减小(合理即给分)。
[解析](2)短周期主族元素中与氯元素相邻的有F和S,根据元素周期律即可推知原子半径的大小关系。
(4)由图可知,Cl2、Br2、I2三者有规律可循(非金属性越强,单质分子的化学键越难断裂;键长越短,键能越大),但F2特殊。
15.答案:D
[解析]本题考查物质结构知识。据题干所给条件可知:甲是H2S。选项A,该盐可能是NaHS或Na2S,溶液显碱性,但NaHS既能与酸反应又能与碱反应,A项错。选项B,相对分子质量为32的18e-的分子有SiH4、CH3OH,所以B项错。选项C,第2周期IVA族元素为C,如CH3OH符合,但CH3OH不是CH4的同系物。选项D,H2S中元素的质量比为1/16(H/S),H2O2分子中元素的质量比也为1/16(H/O),H2O2中氧元素的价态为-1价,符合。
14.答案: C
[解析]先推导出五种元素:由题给信息知,X为H,Y为8O;由“R与Y(8O)同族”知R为16S;进而知Z、W为第三周期;再从“Z、W核外电子数之和 = Y(8O)、R(16S)核外电子数之和 = 24”,可确定Z为11Na、W为13Al。
A项中,O2-、Na+、Al3+具有相同的电子层结构,但离子半径依次减小,A项错。氢与氧可形成H2O和H2O2两种常见化合物,B项错。C项中,热稳定性是XmY(H2O)>XmR(H2S),正确。D项中,W、R的最高价氧化物的水化物分别为Al(OH)3和H2SO4,Al(OH)3为两性氢氧化物,不正确。
13.答案:D
[解析]用“核外的电子数为63”结合常识--“第五周期最后为54、第六周期最后86”,不难推出A项、B项、C项正确。D项,该原子平均中子数为152-63 = 89,据平均值原理,二种同位素的中子数应是一个大于89,一个小于89,而不可能等于89,故D项错。
12.答案:D
[解析]据“类硅”,从相似性上可推导出A、B项正确。从递变性上可推出C项正确(结构相似时,从上至下分子间力增大,沸点升高)、D项错误(从上至下氢化物稳定性减弱)。
11.答案:B
[解析]先找出三种元素,再进行各选项的判断。据题给信息可知有如下关系:
|
IA |
|
|
|
VIA |
|
|
IA |
|
|
|
VIA |
|
|
|
|
|
|
8Z |
|
或 |
|
|
|
|
16Z |
|
|
11X |
… |
Y? |
… |
|
Y? |
|
20X |
… |
Y? |
… |
|
Y? |
因为X、Y、Z原子序数之和为36,所以得X为11Na、Z为8O、Y为17Cl。
同周期(第三周期中)X(Na)的金属性最强,A正确。同周期元素从左向右原子半径减小,原子半径X(Na)>Y(Cl);电子层结构相同的离子,离子半径随核电荷数的增加而减小,离子半径X(Na+)<Z(O2-),B错误。同族元素(VIA族)中Z(O)的氢化物稳定性最高,C正确。同周期(第三周期中)Y(Cl)的非金属性最强,则最高价含氧酸(HClO4)的酸性最强,D正确。
10.答案:B
[解析]处于元素周期表金属与非金属分界线附近的元素,既表现金属性,又表现非金属性,A错误;主族元素的最高正化合价等于它所处的主族序数,也等于其最外层电子数,B正确;C项所述,大多如此,但有例外,如H+是0电子稳定结构,Li+为2电子稳定结构,等等,所以C项错误;同一主族的元素原子,其化学性质相似,但不是完全相同,D错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com