
题目列表(包括答案和解析)
19.(2009·海南化学卷,19-1)在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是 ( )
A.Li,F B.Na,F C.Na,C1 D.Mg,O
18.(2009·上海化学卷,2,)以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的 ( )
A.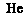 B.
B.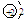 C.1s2 D.
C.1s2 D.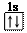
17.(2009·理综安徽卷,7)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是 ( )
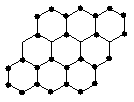
A.石墨烯与石墨互为同位素
B.0.12 g石墨烯中含有6.02×1022个碳原子
C.石墨烯是一种有机物
D.石墨烯中的碳原子间以共价键结合
16.(2009·广东理基,19)下列化学用语使用不正确的是 ( )
A.Na+的结构示意图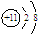
B.纯碱的化学式为Na2CO3
C.聚乙烯的结构简式为CH2=CH2
D.高氯酸(HClO4)中氯元素的化合价为+7
15.(2008年江苏化学·21A)(12分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
 (5)B的最高价氧化 物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
。
(5)B的最高价氧化 物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
。
14.(2008年山东理综·32)(8分)[化学--物质结构与性质]氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为___________。
(2) N
 N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。
N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂__________(填“大”或“小”),可用作__________(填代号)。
a.助燃剂
b.“绿色”溶剂
c.复合材料
d.绝热材料
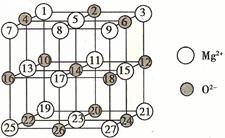
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是_____________,与同一个N3-相连的X+有__________个。
13.(2008年海南化学·25)(11分)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是 、 ;杂化轨道分别是 、 _;a分子的立体结构是 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是 晶体、 晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式) 。
(4)Y与Z比较,电负性较大的 ,其+2价离子的核外电子排布式是 。
12.(2008年广东化学·27)(10分)镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
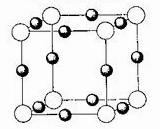
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误: 。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
|
氧化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/K |
1266 |
1534 |
183 |
解释表中氟化物熔点差异的原因: 。
(5)人工模拟是当前研究的热点。有研究表明, 化合物X可用于研究模拟酶,当其结合 或Cu(I)(I表示化合价为+1)时,分 别形成a和b:
或Cu(I)(I表示化合价为+1)时,分 别形成a和b:
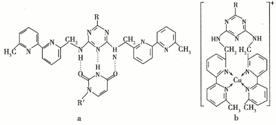
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异 。
11.[化学--选修物质结构与性质](2008年宁夏理综·35)(15分)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
10.(2007年山东理综·32)(8分)[化学-物质结构与性质]请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是 (填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com