
题目列表(包括答案和解析)
7.答案:(1)N(2)Cl K(3)Fe 1s22s22p63s23p63d64s2
(4) Cu 1s22s22p63s23p63d104s1
[考点]本题考查了常见元素种类推断以及原子结构。
[解析](1)A元素原子核外共有5个电子,则核内为5个质子,因此为N。(2)B、C分别为17、19号元素即Cl、K。(3)D3+的电子排布式为1s22s22p63s23p63d5,可知D为26号元素,即Fe,因此其基态原子的电子排布式为1s22s22p63s23p63d64s2。(4)E元素原子核外共有29个电子,即第29号元素为Cu,电子排布式为1s22s22p63s23p63d104s1。
6.答案:A
[解析]化合物的化学式确定的方法为均摊法。X处在正方体的八个顶点上,其个数为: ;Y处在正方体的12条楞上,其个数为:
;Y处在正方体的12条楞上,其个数为: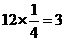 ;Z处在正方体的体心上,其个数为1。
;Z处在正方体的体心上,其个数为1。
5.答案:C
[解析]选项C没有指明p轨道电子和s轨道电子是否处于同一电子层。
4.答案:C
[解析]由于石墨的结构是平面六边形,每个碳原子以sp2杂化轨道的类型形成的三个共价键是正三角形构型,而硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。因此B原子杂化轨道的类型为sp2类型,且羟基之间作用力为氢键。
3.答案:C
[考点]本题考查了NaCl晶胞的结构。
[解析]每个NaCl晶胞中含有的Na+离子和Cl 离子的数目分别是4、4。
离子的数目分别是4、4。
2.答案:D
[考点]本题考查了价层电子对互斥理论的应用。
[解析]H2S为V形;BF3为平面三角形。
1.答案:C
[考点]本题考查了晶体的结构与性质。
[解析]本题中稀有气体为单原子分子无共价键;原子晶体中如SiO2 也存在Si-O极性共价键,B错;在铵盐中既存在离子键又存在共价键,C正确。金属汞的熔点很低,D错。
32.( 2009·广东卷,27)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为_____________________。
(2)下图左是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_________。


(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如上图右:
下列说法正确的是__________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)2]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________。
(5)Cu2O的熔点比Cu2S的_________(填“高”或“低”),请解释原因______________。
高考真题答案与解析
化 学
[考点7] 分子性质 晶体结构及性质
31.(2009·理综山东卷,32)C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式_____________。从电负性角度分析C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,则M 为 (填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成s 键和p 键,SiO2中Si与O原子间不形成上述p 健。从原子半径大小的角度分析,为何C、O原子间能形成,而S、O原子间不能形成上述p 键 。
30.(2009·海南化学卷,19 )已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
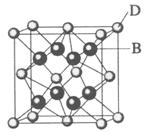
请回答:
(1)A元素的名称是 。
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C与A形成的化合物沸点高,其原因是 。
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为 。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是 (只要求列出算式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com