
题目列表(包括答案和解析)
12.(2009广东理基23)下列有关金属及其合金的说法不正确的是 ( )
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
11.(2009江苏卷5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是 ( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.  的熔点很高,可用于制作耐高温材料
的熔点很高,可用于制作耐高温材料
D. 点解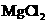 饱和溶液,可制得金属镁
饱和溶液,可制得金属镁
10. (2009广东化学10)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
A. 锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
9.(2007广东24) 二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
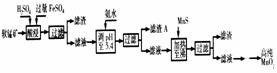
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
 (1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为
。
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为
。
(2)滤渣A的主要成分为
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰干电池中可以回收利用的物质有 (写出两种)。
8.(2008山东理综31) 钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在 部分发生反应,在 部分开始生成铁和炉渣。
(2)炼钢时,除磷的化学方程式为 ;加入硅、锰和铝的目的是 。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹 (填“前”或“后”)加入,原因是 。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是 。从环保和经济角度考虑,上述尾气经处理可用作 。
7.(2008山东理综28) 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为
 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
 S2O
S2O +2I- 2SO
+2I- 2SO +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程: 、 (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 酸性KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
6.(2008广东22)铜在自然界存在于多种矿石中,如: 请回答下列问题:
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
 (2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称
。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。

5.(2008广东6) 相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是 ( )
A.Al B.Al(OH)3 C.AlCl3 D.Al2O3
4.(2007广东4)许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是 ( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
3.(2007宁夏理综12)a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为 ( )
A.1∶7 B.7∶1 C.7∶8 D.8∶7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com