
题目列表(包括答案和解析)
19.(2009·江苏化学卷,12)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是 ( )
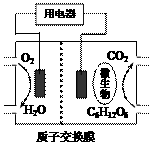
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e- = 6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体 L
L
18.(2009·江苏化学卷,5,)化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
17.(2009·广东卷,14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是 ( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e- = 4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e- = Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
16.(2009·广东理基,34)下列有关电池的说法不正确的是 ( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
15. (2009·理综上海卷,11)茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中 ( )
(2009·理综上海卷,11)茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中 ( )
①铝合金是阳极 ②铝合金是负极
③海水是电解液 ④铝合金电极发生还原反应
A.②③ B.②④
C.①② D.①④
14.(2008山东理综30)(16分)食盐是日常生活的必需品,也是重要的化工原料。
( 1)粗食盐常含有少里K+、Ca2+、Mg2+、Fe3+、S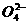 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、S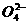 离子,选出a所代表的试剂,按滴加顺序依次为
(只填化学式)。
离子,选出a所代表的试剂,按滴加顺序依次为
(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 。
(2)用提纯的NaCl配制500mL 4.00 mol·L-1
NaCl溶液,所用仪器除药匙、玻璃棒外还有
(填仪器名称)。
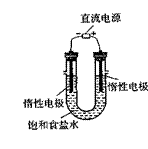 (3)电解饱和食盐水的装置如图所示,若收集的 H2为2 L ,则同样条件下收集的Cl2 (填“>”、“=”或“<”
(3)电解饱和食盐水的装置如图所示,若收集的 H2为2 L ,则同样条件下收集的Cl2 (填“>”、“=”或“<”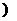 2 L,原因是 。装 置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为
。
2 L,原因是 。装 置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为
。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+ H2SO4 ZnSO4+H2↑
MnO2+4HCL(浓) Mn
Cl2+ Cl2↑+2 H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选 用制备气体的装置:
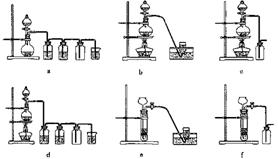
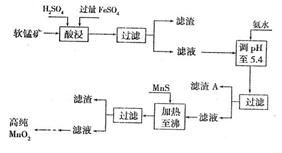
13.(2007广东化学24)(10分)二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分是MnO2,还含Si(16.27%)、Fe(5.86%)、A1(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。回答下列问题
|
沉淀物 |
A1(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
Ma(OH)2 |
Ca(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
|
沉淀物 |
Zn(OH)2 |
CaS |
ZaS |
MaS |
FeS |
|
pH |
8.0 |
[≥0.42] |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将 MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为 。
(2)滤渣A的主要成分为 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰干电池中可以回收利用的物质有 (写出两种)。
12.(2007山东理综29)(15分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。正极反应 负板反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 劣质不锈钢腐蚀的实验现象
11.(2007宁夏理综26)(14分)
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应: ;
银片上发生的电极反应: 。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA = 6.02×1023 /mol, 电子电荷为 1.60×10-19 C)
10.(2008上海化学12)取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现电极与试纸接触处出现一个双色同心圆,内
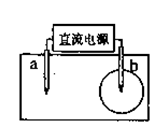 圆为白色,外圆呈浅红色。则下列说法错误的是
( )
圆为白色,外圆呈浅红色。则下列说法错误的是
( )
A.b电极是阴极 B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com