
题目列表(包括答案和解析)
34.答案:A
[解析]本题考查电化学知识的应用。Fe与Zn构成原电池时,活泼的Zn作负极溶解(即阳极,A项错),使正极Fe受到保护(B项对)。C项,钢铁吸氧腐蚀时,Fe作负极被腐蚀,O2在正极(碳)得电子,C项正确。D项,在阳极上失电子能力是Cl->OH-,D项对。
33.答案:B
[解析]粗看装置虽感到陌生,但仔细分析得知该实验是吸氧腐蚀与析氢腐蚀的简单综合。a试管内盛装食盐水,溶液呈中性,发生的是吸氧腐蚀,负极反应式为Fe-2e- = Fe2+,正极反应式为O2+2H2O+4e- = 4OH-,显然a装置内气体的物质的量减少,压强减小。b试管内盛装氯化铵,溶液呈酸性,发生的吸氢腐蚀,负极反应式为Fe-2e- = Fe2+,正极反应式为2H++2e- = H2↑,气体的物质的量增加,压强增大。综上分析选项B错。
32.答案:BC
[解析]合金的熔点一般比各组分的熔点要低,所以A错误。Sn与Cu形成原电池,因Sn比Cu金属活泼性强,所以Sn作负极,Cu作正极,Sn对Cu起到保护作用,B正确。潮湿环境提供电解质溶液,构成了原电池,比干燥环境(不能构成原电池)腐蚀快,C正确。电化学腐蚀同样属于化学反应,D错误。
31.答案: A
[解析]反应①中水既不是氧化剂,也不是还原剂,B错。选项C中钢质(主要成分是Fe)水管与铜质(主要成分是Cu)水龙头构成原电池,较活泼的钢质水管腐蚀速率加快,C错。钢铁可认为是铁碳合金,在潮湿的空气中构成了原电池,易发生电化学腐蚀而使铁生锈。
30.答案:C
[解析]此处铁生锈属于吸氧腐蚀。④处没有和电解质溶液接触,不能构成原电池,锈腐速率较慢;①②③处已与电解质溶液接触,但①②处含O2较少,所以③处腐蚀最快。
29.答案: (1)B。 (2)防止NH4HCO3分解(或减少Fe2+的水解)。
(3)降低K2SO4的溶解度,有利于K2SO4析出。 (4)2SO42 --2e- = S2O82 -。
[解析]先分析各步变化:经反应I后,过滤,所得溶液含(NH4)2SO4、过量的NH4HCO3;反应II是用稀H2SO4与该溶液反应,生成(NH4)2SO4;反应III是在主含(NH4)2SO4的溶液中加KCl,析出K2SO4,NH4Cl留在溶液中;反应IV暂不清楚。
(1)除去FeSO4中的Fe3+,可用Fe屑、I-,但为不引入杂质,只能用铁屑:2Fe3++Fe = 3Fe2+。
(2)温度过高,NH4HCO3会分解,会促进Fe2+的水解。
(3)反应III的目的是析出K2SO4固体,在水中加入极性较小的有机溶剂(如醇类),可降低离子化合物(如K2SO4)在水中的溶解度。
(4)电解时阳极发生氧化反应,S2O82 -中S显+7价,可知是由SO42 -中+6价的S被氧化得到。阴极是H+放电生成H2。
28.答案: (1)氯气; a; d; 浓硫酸。
(2)①SiCl4+2H2+O2 SiO2+4HCl
②0.35
SiO2+4HCl
②0.35
(3)134.4
[解析]本题主要考查电解饱和食盐水的原理、还涉及化学平衡和氧化还原反应的计算。
(1)根据图示装置可知在d处加入的应是饱和食盐水,在阴极和阳极分别发生还原反应和氧化反应,即阴极和阳极产物分别是H2和Cl2,并在阴极出口a处得到NaOH溶液;阳极产生的Cl2可用浓硫酸干燥处理。
(2)①根据信息可知白炭黑为SiO2,再据氧化还原反应原理可以写出制备气相白炭黑的反应。
②生成SiHCl3的消耗的n(H2) = 0.01×20 = 0.2 mol,则起始时n(H2) = 0.2+0.14×20 = 3.0 mol;根据2NaCl-H2和H2为3 mol,可以求得消耗NaCl为0.351 kg;
(3)根据3H2-3Cl2-NaClO3及213.0 kg NaClO3可以求得生成的H2为134.4 m3。
27.答案: (1)由化学能转变为电能 由a到b
(2)2H2+4OH--4e- = 4H2O 或H2+2OH--2e- = 2H2O
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率,同时也增大了Pt的利用率以降低成本
(4)①Li H2O ②1/1148或8.71×10-4 ③32
[解析]本题考查燃料电池的知识,先找出正、负极是解题的关键。通入还原剂(H2)的一极为负极,电极反应为H2+2OH--2e- = 2H2O;通入氧化剂(O2)的极为正极,电极反应为O2+4e-+2H2O = 4OH-。
(4)II..②由反应I知,当吸收10 mol H2时,则生成20 mol LiH,V(LiH) =  = 192 cm3,V(LiH):V(H2) = 192 cm3:224×103 cm3 = 1:1.15×103。
= 192 cm3,V(LiH):V(H2) = 192 cm3:224×103 cm3 = 1:1.15×103。
③由反应关系H2 2LiH
2LiH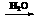 2H2可知,②中10 mol(标准状况224 L)H2,最终可生成20 mol H2,转移电子为:20 mol×2×80% = 32 mol。
2H2可知,②中10 mol(标准状况224 L)H2,最终可生成20 mol H2,转移电子为:20 mol×2×80% = 32 mol。
26.答案: (1)为了防止亚铁化合物被氧化。
(2)CO2 H2O NH3。
(3)Fe+H2PO4- +Li+-2e- LiFePO4↓+2H+。
LiFePO4↓+2H+。
(4) +3NaOH
+3NaOH
 +HOCH2CH2OH+Na2CO3
+HOCH2CH2OH+Na2CO3
+CH3OH
(5)FePO4+Li++e-  LiFePO4
LiFePO4
[思路](1)由亚铁的还原性可以想到选择惰性气氛的原因;(2)因为其他物质为气体,结合质量守恒进行配平可知有CO2、H2O、NH3生成。(3)由于阳极材料是Fe,又因该极生成LiFePO4可以该极的大体转化过程为“Fe LiFePO4”,根据质量守恒可知还有H2PO4- 和Li+参加反应,从而完成电极反应的书写。(5)充电时,被充电池的正极与电源的正极相连,此时被充电池实为电解池,被充电池的正极即为电池解的阳极。
LiFePO4”,根据质量守恒可知还有H2PO4- 和Li+参加反应,从而完成电极反应的书写。(5)充电时,被充电池的正极与电源的正极相连,此时被充电池实为电解池,被充电池的正极即为电池解的阳极。
[解析](1)根据题给信息,磷酸亚铁锂中存在的是Fe2+离子,很容易被空气中的O2氧化,故灼烧时需用惰性气体保护。
(3)方法二中,阳极的电极反应包括Fe原子失去电子生成Fe2+,还有Fe2+与H2PO4- 、Li+的沉淀反应。
(4)M分子中含3个酯键,跟足量NaOH反应时,这3个酯键都会断裂。
(5)可充电电池充电时,发生的反应是电池放电时的逆过程,据此原理,原电池放电时,正极是+3价铁得电子成为+2价铁。
25.答案: (1)Zn; 正极。
(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀; b。
(3)2H++2e- = H2; 87 g。
[解析](1)还原性较强的Zn作负极,失电子有负极经外电路流向正极。
(2)除杂原则是:加入物要过量(以除尽杂质)、不能引入新杂质,故选Zn将Cu2+置换而除去。
(3)阴极上,阳离子得电子,Mn2+和H+比较,应是H+得电子。
由关系式知:MnSO4-MnO2-2e-,通过2 mol电子产生1 mol MnO2,即87 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com