
题目列表(包括答案和解析)
3.(2007广东化学15)下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.0.1mol·L-1Na2CO3溶液:c(OH-)= c(HCO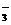 )+ c(H+)+2 c(H2CO3)
)+ c(H+)+2 c(H2CO3)
B.0.1mol·L-1NH4Cl溶液:c(NH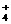 )= c(Cl-)
)= c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)> c(CH3COO-)> c(H+)+ c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)= c(NO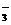 )
)
2.(2007山东理综10)物质的量浓度相同时,下列既能跟NaOH溶液反应、又能跟盐酸溶液中pH最大的是 ( )
A.Na2CO3溶液 B.NH4HCO3溶液
C.NaHCO3溶液 D.NaHSO4溶液
1.(2008海南化学9)下列离子方程式中,属于水解反应的是 ( )
A.HCOOH+H2O HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O HCO
HCO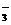 +H+
+H+
|
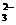 +H2O
+H2O HCO
HCO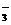 +OH-
+OH-
D.HS-+H2O S2-+H3O+
S2-+H3O+
7.答案:B
[解析]本题主要考查电离平衡,关键是找出二种酸各自的曲线。思路是:两种酸起始pH相同,即c(H+)相同,说明:起始时,c(弱酸溶质)远大于c(强酸溶质);弱酸原来的c(H+)已等于强酸的c(H+),由于稀释使弱酸的电离度增大,所以在稀释的整个过程中,弱酸的c(H+)都大于强酸的c(H+),即pH是:弱酸<强酸,所以曲线II是醋酸、I是盐酸,A项错。由于在整个稀释过程中,醋酸的浓度始终大于盐酸的,所以D项错。溶液导电性强弱取决于离子浓度大小,对于酸而言,其pH越大,c(H+)越小,离子浓度越小,导电能力越弱,所以B项正确。KW的大小只取决于温度,与溶液的浓度无关,C项错。
6.答案:B
[解析]A中没有指明浓度,无法比较。C项中没有指明溶液是否饱和,A盐溶液的溶质质量分数不一定比B盐溶液的大。还原性强弱的比较,与失电子的难易有关,与失电子的多少无关,D不正确。
5.答案:B
[解析]A项,根据HA在水中的电离度可算出c(H+) = 0.1 mol·L-1×0.1% = 10-4 mol·L-1,所以pH = 4。B项,升高温度,促使HA在水中的电离平衡向电离的方向移动,所以c(H+)增大,pH值会减小,B项错。C项,平衡常数为:K = 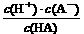 = 1×10-7 ,所以C项正确。D项,c(H+) = 10-4 mol·L-1,所以c(H+)水电离 = c(OH-) = 10-10 mol·L-1,前者是后才的106倍,D项正确。
= 1×10-7 ,所以C项正确。D项,c(H+) = 10-4 mol·L-1,所以c(H+)水电离 = c(OH-) = 10-10 mol·L-1,前者是后才的106倍,D项正确。
4.答案:D
[解析]从题干所给信息可知,磷钨酸在该反应中起到了浓硫酸的作用:催化作用,所以A正确。大多数的钠盐都属于强电解质,即B正确。C项中,三者中都含有PW12O403-原子团,所以C项对。根据化合价代数和为零可推出H4 SiW12O40中W的化合价:4+4+12x =40×2,得x =+6,D项错。
1.答案:(1)124.2
(2)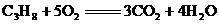 负
负
(3)4.2×
 (4)
(4)
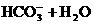
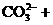

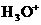 (或
(或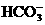
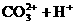 )、
)、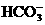 +
+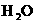

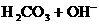 ,
,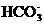 的水解程度大于电离程度
的水解程度大于电离程度
[解析](1)根据盖斯定律,将两反应式相减得到: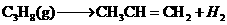
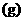
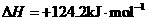 。
。
(2)该燃料电池的电解质是熔融碳酸盐,电池反应方程式是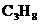 燃烧的方程式。放电时,阴离子向负极移动。
燃烧的方程式。放电时,阴离子向负极移动。
(3)根据平衡常数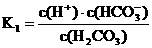 ,
,
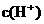 =
=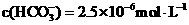 ,
,
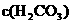 =1.5×10
=1.5×10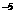 mol
mol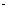 L
L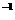 ,可求出
,可求出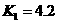 ×
×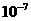
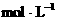 。
。
(4)由 溶液的pH>8得
溶液的pH>8得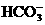 的水解程度大于离程度。
的水解程度大于离程度。
2答案:C
[考点]本题考查了电离平衡移动以及酸碱中和后溶液pH的变化规律。
[解析]水的电离与温度有关,温度越高,电离度越大,但[H+]=[OH-]水仍呈中性,A错;我们知道pH每升高一个单位,对于强酸需要稀释10倍,而对于弱酸稀释的倍数超过了10倍,B中由于醋酸为弱酸,稀释至原来的10倍后,pH<4,B错;在D中,当酸与碱的pH之和等于14时,等体积混合后,谁弱显谁性,即pH<7,D错。
3答案:A
[考点]本题考查了盐的水解规律。
[解析]氯化铵是强酸弱碱盐,水解,显酸性。相当于发生Mg+2H+=Mg2++H2↑ ,而其他溶液均显碱性。所以选A。
7.(2009·理综山东卷,15,)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。据图判断正确的是 ( )
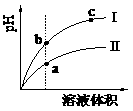
A.II为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
高考真题答案与解析
化 学
[考点11] 弱电解质的电离平衡
6.(2009·上海化学卷,14)根据以下事实得出的判断一定正确的是 ( )
A.HA的酸性比HB的强,则HA溶液pH比HB溶液的小
B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大
C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com