
题目列表(包括答案和解析)
5.(16分)
 居室污染正威胁着人们的健康。SO2、CO、H2S、HCHO等是常见的气体污染物。其中,甲醛被视为新装修居室中的“空气杀手”。我国《居室空气中甲醛的卫生标准》规定,居室空气中甲醛的最高允许浓度是0.08mg·m-3。某研究性学习小组试图用下列装置测定居室空气中甲醛的含量。w.w.^w.k.s.5*
居室污染正威胁着人们的健康。SO2、CO、H2S、HCHO等是常见的气体污染物。其中,甲醛被视为新装修居室中的“空气杀手”。我国《居室空气中甲醛的卫生标准》规定,居室空气中甲醛的最高允许浓度是0.08mg·m-3。某研究性学习小组试图用下列装置测定居室空气中甲醛的含量。w.w.^w.k.s.5*
(1)该学习小组要配制500mL 1.0×10-2mol·L-1的高锰酸钾溶液,则需称取 g高锰酸钾固体。配制高锰酸钾溶液需要使用的玻璃仪器是 。
(2)检验该装置气密性的方法是 。
(3)该装置中碱石灰的作用是 。
(4)已知一氧化碳与高锰酸钾溶液不反应,甲醛与高锰酸钾酸性溶液反应的离子方程式如下,请配平该离子方程式。w.w.^w.k.s.5*
MnO4-+ HCHO+ H+= Mn2++ CO2+ H2O
(5)该学习小组的同学,取2.0mL所配制的高锰酸钾溶液,加入适量稀硫酸,加水稀释成200mL,再从中取出2.0mL,注入试管中。然后,连接好装置,慢慢拉动针筒的活塞对试管抽气,使空气缓缓经过碱石灰进入高锰酸钾溶液。每次抽气50mL,经200次抽气后,高锰酸钾溶液完全褪色。试通过计算,说明该居室空气中的甲醛含量是否超标。
(6)抽气时应慢慢拉动针筒活塞,如果抽拉活塞的速度太快,将会使测定结果 。
①偏高 ②偏低 ③无影响 ④可能偏高,也可能偏低
4.本题有两道题(共18分)w.w.^w.k.s.5*
I.(4分)
(1)下列实验操作中,正确的是 。
A.称量固体药品时,将药品直接放在天平托盘上
B.实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯
C.先将pH试纸用蒸馏水润湿后,再测定溶液的pH
D.金属锂保存在煤油中
E.金属钠不慎燃烧立即用沙子覆盖
F.用100mL量筒量取2.50mL盐酸
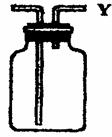 (2)现有下图所示装置,正放在桌面上,可分别实现下列实验目标,其中适用于从Y口进入的是
。
(2)现有下图所示装置,正放在桌面上,可分别实现下列实验目标,其中适用于从Y口进入的是
。
A.瓶内盛一定量液体干燥剂,用于干燥气体
B.瓶内盛一事实上量水,用于制得可溶于水
的气体的饱和溶液
C.瓶内盛满水,用于测量难溶性气体的体积
D.瓶内贮存难溶于水的气体,当加进水时气体可排出w.w.^w.k.s.5*
E.一般用于向上排气法收集某些气体
F.一般用于向下排气法收集某些气体
 II.(14分)课外小组设计了如下图所示的实验装置,进行气体性质实验。图中箭头表示气体流向。A表示一种纯净、干燥的气体,B是另一种气体,反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
II.(14分)课外小组设计了如下图所示的实验装置,进行气体性质实验。图中箭头表示气体流向。A表示一种纯净、干燥的气体,B是另一种气体,反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
根据图中装置和反应现象回答:w.w.^w.k.s.5*
(1)充分反应后丙中无固体物质剩余,则丙中发生反应的化学方程式为 ;
(2)丁中的干燥剂应选 ,不选另一种干燥剂的理由是 ;
(3)甲中发生反应的化学方程式为 ;
(4)观察到反应开始后断开电键K,铂丝能继续保持红热,戊中发生的主要反应的化学方程式为 , 反应是(吸热、放热) 反应;
(5)当已中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞,若将己浸入冰水中,则己中会出现的现象是 ,
简述产生此现象的原因 。
在进行实验时,造成的不良后果是 。
(2)为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作步骤。w.w.^w.k.s.5*
5.(15分)碳酸钠俗称纯碱,是一种常用化学品。工业上制取碳酸钠的方法是:将二氧化碳和氨气通入饱和食盐水中,控制一定温度,制得碳酸氢钠,再煅烧碳酸氢钠使其转化为碳酸钠。有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3
 NH4HCO3+NaCl=NaHCO3↓+NH4Cl
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3 +CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水
B.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
C.碳酸氢钠受热易分解
(2)某探究活动小组根据工业制取碳酸钠的原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。w.w.^w.k.s.5*

i.乙装置中的试剂是 (填标号)。
A.烧碱溶液 B.澄清石灰水 C.浓氨水 D.蒸馏水
ii.丁装置的作用是 。
iii. 实验结束后,分离出NaHCO3晶体的操作是 (填名称)。
②另一位同学用下图中戊装置(其它装置未画出)进行实验。w.w.^w.k.s.5*
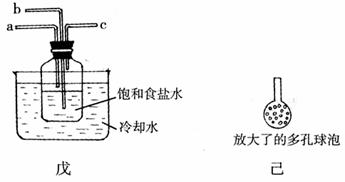
i. 实验时,须先从a管通入 气体,再从b管通入 气体。
ii. 有同学建议在b管下端连接上图中已装置,理由是
。
(3)请你再写出一种实验室制取少量碳酸氢钠的方法。w.w.^w.k.s.5*
I.实验装置如图1所示
(1)写出浓硝酸受热分解的化学方程式:w.w.^w.k.s.5*
;
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是
。
II.实验装置如图2所示:
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,试写出该反应的化学方程式: ;
(2)当集气瓶中充满红棕色气体时,余烬木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是
;
25.答案: (1)向左;不改变。 (2)-77.6 kJ·mol-1。
(3)Cu(OH)2;2NH3·H2O+Cu2+=Cu(OH)2↓+2NH4+ ;
(4)中;mol·L-1
[解析](1)恒温、恒压条件下向平恒体系中通入氩气,使总体积增大,相当于稀释原体系,平衡左移;使用催化剂只是改变了反应的途径,没有改变反应物与生成物的状态,DH不变;
(2)利用盖斯定律,DH1+DH2+(-DH3) = -78.2 kJ·mol-1;
(3)由于,KsP[Cu(OH)2]<Ksp[Mg(OH)2],所以先生成Cu(OH)2沉淀;
(4)根据电荷守恒:c(NH4+ )+c(H+) = c(Cl-)+c(OH-),现c(NH4+ ) = c(Cl-),必有c(H+) = c(OH-),故溶液显中性。
Kb =  ,c(NH4+ ) = c(Cl-)=0.005 mol·L-1;c(H+)=c(OH-)=1×10-7 mol·L-1(因为是25 ℃下且为中性);c(N
,c(NH4+ ) = c(Cl-)=0.005 mol·L-1;c(H+)=c(OH-)=1×10-7 mol·L-1(因为是25 ℃下且为中性);c(N
H3·H2O)=( -0.005)
mol·L-1,所以:Kb =
-0.005)
mol·L-1,所以:Kb =  mol·L-1。
mol·L-1。
|

|
版权所有:()
版权所有:()
24.答案:B
[解析]A项,由于Mg(OH)2的溶度积小,故其电离出的Mg2+浓度要小一些,所以A项错。B项,
NH4+ 可以结合Mg(OH)2电离出的OH-离子,从而促使Mg(OH)2的电离平衡正向移动,c(Mg2+)增大,B项正确。C项,Ksp仅与温度有关,故C项错。D项,虽Mg(OH)2的Ksp较小,但二者的Ksp相近,当c(F-)较大时,仍会出现c(Mg2+)·{c(F-)}2>Ksp[MgF2],从而生成MgF2沉淀,故D错。
23.答案:BC
[解析]平衡常数只与温度有关,与物质的浓度无关,A错误。由图可知,c(SO42 -)相同时,三个不同温度中以313 K的c(Sr2+)最大,所以平衡常数Ksp = c(Sr2+)·c(SO42 -)最大,B正确。从图中数据大小可知:一定温度时线下的点都是浓度偏小,处于不饱和状态所以C项正确;线上的点处于过饱和状态(D项错误:原状态处在363 K线的上方)。
22.答案: AC
[解析]0.01 mol·L-1 NH4HSO4中加NaOH溶液,当1:1与H+反应结束后,由于NH4+ 水解呈酸性,需再加NaOH与NH4+ 反应使溶液呈中性,所以c(Na+)>c(SO42 -)>c(NH4+ ),A项正确。B项中,虽然HCO3- 水解呈碱性,但水解微弱,c(Na+)与c(HCO3- )数值接近,所以c(Na+)>c(HCO3- )>c(OH-)>c(H+),故B项错。C项中把c(H+)移项得:c(OH-) = c(HCO3- )+2c(H2CO3)+c(H+),这是质子守恒,所以C项对。D项,[方法1]由电荷守恒有:c(Na+)+c(H+) = c(CH3COO-)+c(OH-),物料守恒有:2c(Na+) = c(CH3COO-)+c(CH3COOH),两式联立得:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+),因溶液pH = 4.75,即c(H+)>c(OH-),得c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),D不正确;[方法2]若溶液呈中性,则有:c(CH3COO-)+c(OH-) = c(CH3COOH)+c(H+),现呈酸性,即以CH3COOH电离为主,右边增(H+)、减(CH3COOH)值相同,左边增(CH3COO-)值>减小(OH-)值,所以,c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),D项错。
21.答案:C
[解析]此题可利用电荷守恒,以B项为参照点进行解题:溶液中不可能二种阴离子都多于阳离子(C项错),也不可能二种阴离子都少于阳离子。
20.答案:B
[解析]A、C项实是比较c(H+):①CH3COOH(弱酸性)>③CH3COO-(水解呈弱碱性)>④HCO3- (比CH3COO-水解能力强)>②NaOH(强碱性),即pH为①<③<④<②,所以A、C项错误。
B项比较c(CH3COO-):原条件中都有相同的CH3COO-,①因反应使c(CH3COO-)明显减小,③只存在CH3COO-的水解,②因有NaOH抑制了CH3COO-的水解,④中HCO3- 的水解强于CH3COO-,生成的OH-也抑制了CH3COO-的水解,但比②的抑制作用要弱,所以B项正确。
D项的顺序应与B项相反,即应为:①>③>④>②,D项错。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com