
题目列表(包括答案和解析)
4.有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C的外围电子构型为3d104s1。D位于A的下一个周期,是构成地球上矿物界的主要元素。请回答下列问题:
(1)元素A能形成多种单质,其中的一种单质能用作电极、润滑剂与制造铅笔等。A与D所形成的化合物属于 晶体,其中心原子是以 杂化成键;
(2)B的核外电子排布式为 ,
(3)向含有C的硫酸盐中逐滴滴加氨水,所观察到的现象是
;再向上述溶液中加入乙醇,有 ;原因是
;
(4)A的氢化物比D的氢化物相比,熔点高是的 ,理由是
;
(5)下列说法中正确的( )
a.岩浆晶出规则是晶格能高的晶体最后才析出
 b.钾型与铜型都是密置层堆积方式
b.钾型与铜型都是密置层堆积方式
c.在干冰晶体内,每一个CO2周围有12个紧邻的分子
d.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点要高

3.(12分) (1)1s22s22p63s23p63d24s2 (2分) (2) sp2 (1分) c(1分)
(3)①ⅡA (1分) ②Si(1分);2(1分)
(4) SiC(1分);因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC 中C-Si 键键长比晶体Si 中Si-Si键短,键能大,因而熔沸点高(2分)
(5)CaTiO3(2分) ,
3.(1)金属钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,写出Ti元素的基态原子电子排布式为 __;
(2)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有 (填字母):
a.2个σ键;b.2个π键;c.1个σ键、1个π键。
(3)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素位于周期表的第 族
②第三周期8种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图B中的序号)。



(4)由C原子跟Si原子以1 : 1相互交替结合而形成的晶体,晶型与晶体Si相同。两者相比熔点更高的是 (填化学式)试从结构角度加以解释: ______________________________________________________________________。
(5)某化合物的晶体中的晶胞堆积方式如下图所示:
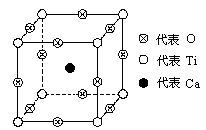
请回答:该化合物的化学式是: 。
2. 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请
回答下列问题。
(1)砷原子核外电子排布式为
(2)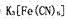 晶体中
晶体中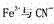 之间的键型为 ,该化学键能够形成的原 因是 (
之间的键型为 ,该化学键能够形成的原 因是 (
(3)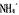 中氮原子的杂化类型为 ,
中氮原子的杂化类型为 ,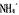 的空间构型为
的空间构型为
(4)已知:
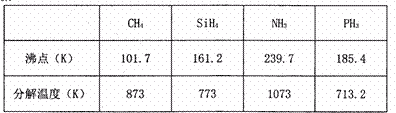
分析上表中四种物质的相关数据,请回答:
①CH4和S iH4比较,NH3和PH3比较,沸点高低的原因是
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是______
结合上述数据和规律判断,一定压强下HF和HC1的混合气体降温时 先液化。
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:

请回答下列有关问题:
①估计钙元素的电负性的取值范围: <X<

 ②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AIC13中形成的化学键的类型及其理由是__ _。
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AIC13中形成的化学键的类型及其理由是__ _。

1.(1)②(1分)(2)三角锥(1分) 分子晶体(1 分)
(3)1S22S22P63S23P4(2分) NH3 与水分子形成氢键且发生化学反应(2分,两个要点,每个要点1分)
(4)1:1(1分) 离子键、非极性键(或离子键、共价键)(2分)
1. 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个末成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个末成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、B两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题。
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个末成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个末成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、B两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题。
(1)A单质、B单质、化合物R的熔点大小顺序为下列的__________(填序号)
①A单质>B单质>R ②R>A单质>B单质
③B单质>R>A单质 ④A单质>R >B单质
(2)CB3分子的空间构型是___________,其固体时的晶体类型为____________。
(3)写出D原子的核外电子排布式____________________,C的氢化物比D的氢化物在水中溶解度大的多的原因__________________________。
(4)D和Fe形成一种黄色晶体FeD2,FeD2晶体中阴、阳离子数之比为_____________,
 FeD2物质中具有的化学键类型为______________________________。
FeD2物质中具有的化学键类型为______________________________。
25.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx
与NaClO的物质的量之比为1:16,则x值是 ( )
A.2 B.3 C.4 D.5
24.分子式为C4H8O3的有机物,一定条件下具有如下性质:①在浓硫酸存在下,能分别与
CH3CH2OH或CH3COOH反应;②在浓硫酸存在下,能脱水生成一种能使溴水褪色的物
质,该物质只存在一种结构形式;③在浓硫酸存在下,能生成一种分子式为C4H6O2的
五元环状化合物。则C4H8O3的结构简式为 ( )
A.HOCH3COOCH2CH3 B.CH3CH(OH)CH2COOH
C.HOCH2CH2CH2COOH D.CH3CH2CH(OH)COOH
23. 在一密闭容器中,反应aA(气) bB(气)达平衡后,保持温度不变,将容器体积
在一密闭容器中,反应aA(气) bB(气)达平衡后,保持温度不变,将容器体积
增加一倍,当达到新平衡时,B的浓度是原来的60%,则 ( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.化学计量数a>b
21.A、B、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生下图所示转化,
其中a是单质;b在通常状况下是气体;c、d都是氧化物;e是该元素的最高价氧化物
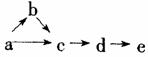 对应水化物,且是一种强电解质;则a可能是 ( )
对应水化物,且是一种强电解质;则a可能是 ( )
A.Cl2 B.N2
C.S D.C
|
A.碳酸氢铵溶液与过量烧碱溶液共热:NH4++OH- NH3↑+H2O
B.次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2=HclO+HCO3-
C.小苏打溶液与石灰水混合:HCO3-+OH-=CO32-+H2O
D.氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com