
题目列表(包括答案和解析)
9. 随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式: ;
 (2)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为 和 (各举一种即可,填化学式),CO分子的结构式可表示成 。
(2)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为 和 (各举一种即可,填化学式),CO分子的结构式可表示成 。
(3)[Fe(CO)5]常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断[Fe(CO)5]的晶体类型为 ,它的空间构型为 ,类似于PCl5,PCl5中心原子的轨道杂化方式为 ,若有两个氯原子被其他相同原子所取代,则其取代产物的结构有 种。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ,CH3OH的熔、沸点比CH4高,其主要原因是 。
8. (1)ds; ⅡB 6
(2)N2O CO2 CNS-
(3)三角锥型 sp3
(4)增大 因为苏丹红I形成分子内氢键,而修饰后的分子可形成分子间氢键,与水分子间形成氢键后有利于增大化合物在水中的溶解度

8. (1)原子结构与元素周期表存在着内在联系。根据所学物质结构知识,请你回答下列问题:
①具有(n-1)d10ns2电子构型的元素位于周期表中 区和 族。
②日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未
成对电子数为 。
(2)等电子原理--原子总数相同、价电子总数相同的粒子具有相似的化学键特征,它们
的许多性质是相近的。写出二种由多个原子组成的含有与N3-电子数相同的粒子的化学
式 、 。
(3)氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。氯化亚砜
分子的几何构型是 ;中心原子采取 杂化方式。
(4)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重
危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ 4种类型,苏丹红Ⅰ号的分子结构如图1所
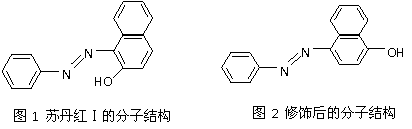 示。
示。
苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图2所示的结构,则其在水中的溶解度会______ ___(填“增大”或“减小”),原因是 。
7. ⑴1s22s22p63s23p63d84s2 ⑵正方体的八个顶点和六个面心 ⑶C ⑷极性 PCl3(或NCl3或NF3) ⑸HF先液化,因为HF分子间存在氢键,而HCl分子间没有,HF的沸点高于HCl
⑴1s22s22p63s23p63d84s2 ⑵正方体的八个顶点和六个面心 ⑶C ⑷极性 PCl3(或NCl3或NF3) ⑸HF先液化,因为HF分子间存在氢键,而HCl分子间没有,HF的沸点高于HCl
亮点:问题(2)来自于教材
7. 上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念。在随后的几年内,科学家又相继合成了氙的氟化物、 氧化物等。
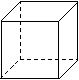 ⑴Pt与Ni在周期表中位于同一族,写出基态Ni原子的核外电子排布式________________________________。
⑴Pt与Ni在周期表中位于同一族,写出基态Ni原子的核外电子排布式________________________________。
⑵金属Pt内部原子的堆积方式与铜相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置__________________________。
⑶稀有气体(氡除外)中,只有较重的氙能含成出多种化合物,其可能原因是___________________(填字母代号)
A.氙的含量比较丰富 B.氙的相对原子质量大
C.氙原子半径大,电离能小 D.氙原子半径小,电负性大
 ⑷已知XeO3分子中氙原子上有1对孤对电子,则XeO3为____________分子(填“极性”或“非极性”),试写出一种由短周期主族元素组成的与XeO3互为等电子体的分子式________________________。
⑷已知XeO3分子中氙原子上有1对孤对电子,则XeO3为____________分子(填“极性”或“非极性”),试写出一种由短周期主族元素组成的与XeO3互为等电子体的分子式________________________。
⑸在一定压强下,将HF和HCl的混合气体降温时,哪一种物质首先液化?试解释其原因。________________________________________________________________。
6.(1)3d54s1
(2)sp3 ; 分子晶体
(3)N>O;三角锥形 , CO2,或CS2、N2O、BeCl2) CNO-
(4)HF分子之间有氢键,形成(HF)n
(5)Na2BeO2
(6)2∶3,(或8∶12、4∶6)
6. 下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
 |
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
⑧ |
|
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
|
|
试填空。
 (1)写出上表中元素⑨原子的外围电子排布式
。
(1)写出上表中元素⑨原子的外围电子排布式
。
(2)元素③与⑧形成的化合物中元素③的杂化方式为: 杂化,其形成的化合物的晶体类型是:______________ _ _。
(3)元素④、⑤的第一电离能大小顺序是: > (用元素符号表示);元素④与元素①形成的X分子的空间构型为: 。请写出与N3-互为等电子体的分子、离子的化学式 , (各写一种)。
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式 。
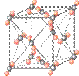
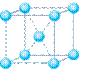
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为: 。

5.(1)1S22S22P4;(2分)(2)H2S或NH2-;(2分)
(3)A;(1分)(4)BC;(1分)(5)20; (1分)
(6)Cu2++4H2O=[Cu(H2O)4]2+ (2分)
5.水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒(写两种) 、 。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)

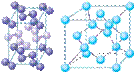
A B C D E
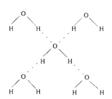 (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了
一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:
。
4.(1)原子晶体 sp3 (各1分,共2分) (2)[Ar]3d104s24p5或1s22s22p63s23p63d104s24p5(1分) (3)开始有蓝色沉淀生成,随着氨水的滴入,沉淀的量逐渐增加至最多后开始溶解,最后蓝色沉淀完全消失,形成深蓝色的透明溶液 (2分) 深蓝色晶体析出 (1分) [Cu(NH3)4]SO4·H2O易溶于极性溶剂,难溶于极性较小或非极性溶剂 (1分) (4)SiH4 (1分) CH4与SiH4是组成与结构相似的物质,而CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低 (1分) (5)c(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com