
题目列表(包括答案和解析)
14. 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
⑴配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
⑵配合物 分子内的作用力有
(填编号)。
分子内的作用力有
(填编号)。
A.氢键 B.离子键 C.共价键 D.配位键

 ⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③
⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③ 、④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序号),预测HCHO分子的立体结构为
形。
、④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序号),预测HCHO分子的立体结构为
形。
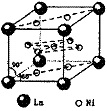
⑷氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点。该晶体的化学式 。
13. (1)平面正三角形(1分) N>S>Si(1分)
(2)N2O4(1分) 第四周期ⅤA(1分) 3d54s2(1分)
(3) N2,CO,C22-,CN-(4个中任选3个,每个1分) 1(0.5分) 2(0.5分)
(4)4(1分) 8(1分) 8(0.5分) 16(0.5分)
解析:(1) SiO32-、SO32-、NO3-三种离子中中心原子的杂化类型均为sp2杂化,离子构型为平面正角形,键角为120°(3)π键和σ键共存在,多重键中只有一个是σ键,其余均为π键,如双键中有1个σ键和1个π键,叁键中有1个σ键和2个π键。(4)PO43-中P原子以4个sp3杂化轨道和4个O原子成键,所以P为4配位氧。根据题意可先计算出Si晶胞中Si原子数:8×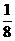 +6×
+6×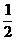 +4=8(个),SiO2晶胞中Si原子数目与硅晶胞中Si原子数目相同,再可结合SiO2晶体中硅氧原子数目1:2的特点可确定晶胞中O原子数有16个(对题中描述的复杂结构可视为干扰条件)。
+4=8(个),SiO2晶胞中Si原子数目与硅晶胞中Si原子数目相同,再可结合SiO2晶体中硅氧原子数目1:2的特点可确定晶胞中O原子数有16个(对题中描述的复杂结构可视为干扰条件)。
13. 等电子体原理是指两个或两个以上的分子(或离子),它们的原子数相同,分子(或离子)中价电子数也相同,这些分子(或离子)常具有相似的电子结构,相似的几何构型,而且有时在性质上也有许多相似之处。
(1)SiO32-、SO32-、NO3-三种离子是等电子体,三种离子的几何构型为__________,其中Si、S、N三种基态原子的第一电离能大小关系为_____________________。
(2)C2O42-和 是等电子体,C2O42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色,Mn原子在元素同期表中的位置是__________,外围电子构型为__________。
(3)二原子14电子的等电子体共同特点是物质中都具有共价叁键,请举出相应的3个例子____________________(可以是分子或离子)。每个分子或离子中含_____个σ键,______个π键。
(4)过去生产上常以SiO2为催化剂的载体,它和近十几年来应用日广的AlPO4是等电子体,在AlPO4中 P为 配位氧。SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞,则一个硅的晶胞中有________个Si原子。再在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有_______个Si原子,______个O原子。
12. ⑴ C2H2、HCN、CO N2 CO  ⑵ sp3 sp2 ⑶1∶2
⑵ sp3 sp2 ⑶1∶2

12. ⑴
原子数目和电子总数(或价电子总数)相同的微粒互称等电子体,等电子体具有相似的结构特征。试写出短周期元素形成的含有14个电子的分子的化学式:________,其中_____和_____互为等电子体,CO分子的电子式为______________。
⑴
原子数目和电子总数(或价电子总数)相同的微粒互称等电子体,等电子体具有相似的结构特征。试写出短周期元素形成的含有14个电子的分子的化学式:________,其中_____和_____互为等电子体,CO分子的电子式为______________。
 ⑵
CH3CHO分子中,-CH3中的碳原子采用________杂化方式,-CHO中的碳原子采取______杂化方式。
⑵
CH3CHO分子中,-CH3中的碳原子采用________杂化方式,-CHO中的碳原子采取______杂化方式。
⑶ 2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为_____。
11. ⑴ 3d54s2 由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d4状态转变为较稳定的3d5半充满状态)
⑵ ① 具有孤对电子 ② sp ⑶ 分子晶体 ⑷ 2∶1 8 12
11. Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
⑴ Mn元素的基态原子电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是 ;
⑵ Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是 ,写出一种与NH3互为等电子体的阳离子的结构式 ;
⑶ 三氯化铁常温下为固体,熔点282℃,沸点315℃,
在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮
等有机溶剂。据此判断三氯化铁晶体为 ;
⑷ 金属铁的晶体在不同温度下有两种堆积方式,晶胞
分别如右图所示。 体心立方晶胞和面心立方晶胞中实际
体心立方晶胞和面心立方晶胞中实际
含有的Fe原子个数之比为 ;两种堆积方式中Fe原子的配位数分别为 和 。
10. ⑴ YBa2Cu3O7
⑵① 1s22s22p63s23p63d5
② 三角锥型 第VA族元素的氢化物在晶体时都是分子晶体,PH3、AsH3、SbH3的分子间没有氢键,相对分子质量越大,范德华力越大,它们的沸点依次升高,但NH3分子间能形成氢键,其沸点比相邻的 PH3高
⑶ N的原子半径大于O,得电子能力大于O,故N元素的电负性小于O;N得2p能级半充满,故N的第一电离能大于O
 ⑷
⑷  sp
sp
10、超导体是一类特殊的电子导体,一定温度以下它的电阻率会突然下降为零。
 ⑴ YBCO-123是一种由Ba、Y(钇)、Cu、O四种元素组成的铜基超导材料,其晶胞如右图所示,YBCO-123的化学式可表示为: 。
⑴ YBCO-123是一种由Ba、Y(钇)、Cu、O四种元素组成的铜基超导材料,其晶胞如右图所示,YBCO-123的化学式可表示为: 。
⑵ 最近我国科学家研制出世界上首例性能优于铜基超导材料的铁基超导材料:(La1-xSrx)OFeAs,其中铁的化合价为+3。
① 写出Fe3+的基态电子排布式 。
② 该铁基超导材料中As位于元素周期表中第VA族。第VA族元素气态氢化物的沸点列于下表:
|
氢化物 |
NH3 |
PH3 |
AsH3 |
SbH3 |
|
沸点(℃) |
-31 |
-89 |
-63 |
-14 |
AsH3分子的空间构型为 ;第VA族元素气态氢化物的沸点先由高到底再由低到高的原因是 。
⑶ N元素的电负性小于O,但N的第一电离能大于O。试分析其原因
。
⑷ N3-与CO2互为等电子体,写出N3-的电子式 ,其中心原子的轨道杂化类型为 。

9. (1)1s22s22p63s23p63d64s2或[Ar]3d64s2
(2)N2、CN-、C≡O
(3)分子晶体 三角双锥 dsp3 三种
(4)CH4和CH3OH CH3OH形成分子间氢键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com