
题目列表(包括答案和解析)
3. 答案..(1)CuO+2H+=Cu2++H2O,Fe2O3+6H+=2Fe3++3H2O,Cu+2Fe3++2Fe2++Cu2+
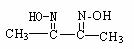 (2)4Fe2++O2+4H+=4Fe3++2H2O
(2)4Fe2++O2+4H+=4Fe3++2H2O
(3)n3=n1+n2-2
(4)4OH- -4e-=2H2O+O2 (5)B(6)A
3. 现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。


 已知:①Cu2O+2H+=Cu2++Cu +
H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
已知:①Cu2O+2H+=Cu2++Cu +
H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
、 (写其中2个各2分)
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式 。2分
 (3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等。
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等。
某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个 三种基团,
无环状结构,三种基团的数目关系为n3= 。2分若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 1分
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 1分
(5)该工艺最大亮点是它符合下列原理 。1分
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒
E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:①铁片置于硫酸铜溶液中有铜析出;②铁、铜和氯气反应分别生成FeCl3和CuCl2;③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;④铜片置于FeCl3溶液中铜片逐渐溶解;⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生。以上设计合理的有 。1分
A.两种方案 B.三种方案 C.四种方案 D.五种方案
2. 答案.(1)温度较低(2分)
(2)2NaCl + 2H2O
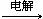 2NaOH + H2↑ + Cl2↑(2分)
2NaOH + H2↑ + Cl2↑(2分)
(3)Fe元素的化合价显+6价,易得电子(2分)
(4)10 mol/L(2分)
(5)AC(2分)
(6)KNO3 KCl, KNO3可用于化肥,炸药等(合理就给分)(2分)
2. 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

 已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
 (2)写出工业上制取Cl2的化学方程式
;
(2)写出工业上制取Cl2的化学方程式
;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
1. (1) MnSO4 (1分)
(2)增大溶液的pH,使Fe3+和 Al3+生成沉淀; (1分)
使形成胶体的氢氧化铝和氢氧化铁也生成沉淀;(1分) H2SO4 (1分)
(3) Fe2O3、Al2O3、S (各1分) (4)纯碱 、H2SO4 (各1分) (5)降温结晶 (1分) (6)1.03(或1)(2分)
1. 某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)
共同生产MnO2和Zn(干电池原料):
|
 ② IV中的电解反应式为MnSO4+ZnSO4+2H2O
MnO2+
Zn+2H2SO4。
② IV中的电解反应式为MnSO4+ZnSO4+2H2O
MnO2+
Zn+2H2SO4。
(1)A中属于还原产物的是__________
______。(1分)
(2)MnCO3、Zn2(OH)2CO3的作用是 ;(1分)II需要加热的原因是 (1分);C的化学式是________________。(1分)
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_______________________。(3分)
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。(2分)
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、
________、过滤、洗涤、干燥等。(1分)
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______。(2分)
7.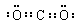 (1)四;VIII (2)
(3)3Fe3O4+8Al
(1)四;VIII (2)
(3)3Fe3O4+8Al 4Al2O3+9Fe
4Al2O3+9Fe
(4)2Al+2OH-+2H2O==2AlO2-+3H2↑ (5)3Fe+4H2O(g) Fe3O4+4H2↑
Fe3O4+4H2↑
(6)镁带剧烈燃烧,放出耀眼的光,瓶壁出现白色固体和黑色颗粒;
 2Mg+CO2
2Mg+CO2 2MgO+C
2MgO+C
7. A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:

请回答下列问题:
(1)元素A在元素周期表中的位置为 ▲ 周期 ▲ 族。
(2)写出K的电子式 ▲ 。
(3)写出H和D反应的化学方程式 ▲ 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 ▲ 。
(5)写出A与G反应的化学方程式 ▲ 。
(6)K与E反应时产生的现象有 ▲ ;
该反应的化学方程式为 ▲ 。
6. (1)HNO3 Ag (每空1分)
(2)氧气 氢氧化铜悬浊液(或其他合理答案) (每空2分)
(3)①4Ag++2H2O = 4Ag↓+4H++O2↑ (2分)
②HCHO+2Ag(NH3)2++2OH-  HCOO-+NH4++2Ag↓+3NH3+H2O (2分)
HCOO-+NH4++2Ag↓+3NH3+H2O (2分)

6. 下图是一些常见物质间的转化关系图,图中所有物质含有的元素中只有一种不是短周期元素,所有反应物、生成物及溶液中的水均未标出,反应②中还有3种产物未标出,x是室内装潢材料中产生的主要有害气体之一,G是由四种元素组成的强碱。

 回答下列问题:
回答下列问题:
(1)写出下列物质的化学式:B 、C ;
(2)列举两种能氧化x的物质(单质、化合物各一种) 、 ;
(3)写出反应①②的离子方程式:
①
② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com