
题目列表(包括答案和解析)
2.由于压强的变化对非气态物质的浓度无影响,因此.当反应混合物中不存在气态物质时,压强的变化对化学平衡无影响。
1.当反应混合物中存在与其他物质不相混溶的同体或纯液体物质时,由于其浓度是恒定不变的常数,不随其量的增减而变化,故改变这些同体或纯液体的量.化学平衡不移动。
勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强或温度),平衡就向着能够减弱这种改变的方向移动。
应用“勒夏特列原理”,需注意下列问题:
(1)影响化学平衡的因素是浓度、压强和温度,催化剂只影响速率,不影响平衡。
(2)原理的适用范围是只有一项条件变化的情况(温度、压强或一种物质的浓度),当多项条件同时发生变化时.情况比较复杂。
(3)平衡移动的结果只能减弱(不可能抵消)外界条件的改变。
10.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
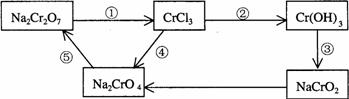
(l)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 (填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□
9.38.4毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体22.4毫升(标准状况),反应消耗的HNO3的物质的量可能是
(A)1.0×10-3摩尔 (B)1.6×10-3摩尔 (C)2.2×10-3摩尔 (D)2.0×10-3摩尔
8.X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为
(A)X>Z>Y>M (B)X>Y>Z>M (C)M>Z>X>Y (D)X>Z>M>Y
7.硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水.反应中生成的氧化产物和还原产物的物质的量之比是
(A)1:3 (B)2:3 (C)1:1 (D)4:3
6.24毫升浓度为0.05摩/升的Na2SO3溶液,恰好与20毫升浓度为0.02摩/升的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是
A.+6 B.+3 C.+2 D.0
5.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
(A)在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多
(B)同价态的阳离子,甲比乙的氧化性强 (C)甲能跟稀盐酸反应放出氢气而乙不能
(D)将甲、乙作电极组成原电池时,甲是负极
4.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物.当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是
(A)NO2 (B)NO (C)N2O (D)N2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com