
题目列表(包括答案和解析)
7、回答下面问题:
(l)分离沸点不同但又互溶的液体混合物,常用什么方法?
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静量分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
6、实验室有一包 KCl和 AlCl3的固体混合物,通过以下实验可确定 KCl和 AlCl3的质量之比,试根据实验方法和主要步骤,回答有关问题:
(1)调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向 旋动。
 (2)某学生用已知质量为 y
g的表面皿准确称取 W g样品,他在托盘天平的右盘上放上(W+y)g的砝码,在左盘的表面皿中放入样品,此时指针稍偏右边,该学生应怎样操作
;
(2)某学生用已知质量为 y
g的表面皿准确称取 W g样品,他在托盘天平的右盘上放上(W+y)g的砝码,在左盘的表面皿中放入样品,此时指针稍偏右边,该学生应怎样操作
;
(3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧坏中有沉淀物,则A溶液的名称是 ;
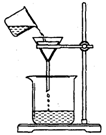
(4)过滤,某学生欲用右图装置操作,错误之处应怎样纠正?
答: ;
(5)甲学生用水多次洗涤过滤所得沉淀物,然后使其干燥,得到固体纯净物C,质量为W2g,C的名称是 ;
(6)乙学生将过滤所得滤液跟甲学生洗涤沉淀所得液体混合,然后蒸干溶剂,再充分加热,最后得到纯净KCl固体W1g,则原混合物中KCl与AlCl3的质量之比的计算式为 。
5.上述实验及结论在科学上是错误的。由于NO2干扰了O2的检验,因此应选用NaOH溶液除掉NO2后再检验。
[例2] 研究某一化学反应的实验装置如下图所示:
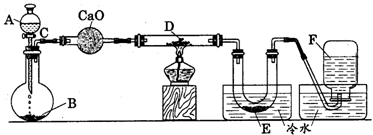 A-F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氟水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
A-F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氟水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象;
(1)D物质由黑色变为红色
(2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液
(3)点燃的镁条伸入无色无味的F中.镁条表面生成一种灰黄色固体物质。将该发黄色物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
①、写出A-F的物质名称:
A ,B ,C ,D ,E ,F 。
②、写出有关的化学方程式:
A与B ;
C与D ;
E与无水硫酸铜 ;
F与Mg ;
F与Mg的反应产物与水 。
4、将1体积选项中的一种气体与10体积O2混合后,依次通过盛有足量浓NaOH溶液的洗气瓶和盛有足量灼热铜屑的管子(假设反应都进行完全),最后得到的尾气可以是( )
A.Cl2 B.CO C.CO2 D.N2
3.下列除杂方法中,正确的是( )
A.用灼烧法除去二氧化锰中混有的炭粉
B.用点燃法除去CO2中混有的少量CO
C.将H2和O2混和气体通过赤热的CuO以除去氧气中的氢气
D.干燥H2S中的水蒸气,将混和气通过浓硫酸的洗气瓶
2.下列混和物可用分液漏斗分离的是( )
A.苯和溴苯 B.乙酸乙酯与碳酸钠溶液
C.甘油和水 D.苯和三溴苯酚
1.检验某未知溶液中时否含有SO42-,下列操作最合理的是( )
A.加入稀硝酸酸化的Ba(NO3)2溶液 B.加入盐酸酸化的BaCl2溶液
C.先加稀硝酸酸化,再加Ba(NO3)2溶液 D. 先加盐酸酸化,再加BaCl2溶液
2、物质检验的方法:
一般是根据物质的物理性质(如颜色、状态、气味、密度等)或利用化学性质。在做题时必须交待操作步骤、观察到的现象以及根据现象而得的结论。同时要注意共有现象的干扰。如:
(1) 和Na2SO4均能与酸化的Ba(NO3)2产生白色沉淀,CO2和 通入澄清石灰水产生沉淀,继续通入则都可变澄清。
(2)检验SO42-离子存在的正确方法是:先用盐酸酸化,这样可排除CO32-、SO32-、Ag+等离子的干扰,再加 溶液,若有沉淀生成,则证明一定有SO42-离子存在。
典型例题:
[例1]为了除去粗盐中的 Ca2+、Mg2+、SO42-及泥砂,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是 ( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量 Na2C03溶液 ⑤加过量 BaCl2溶液
A、①④②⑤③ B、④①②⑤③ C、②⑤④①③ D、⑤②④①③
解析:必须了解各个实验步骤的目的,才能分清操作顺序。加入过量的NaOH溶液的目的是除去Mg2+,加入过量的BaCl2溶液是为了除去SO42-,加入过量的Na2C03溶液是为了除去 Ca2+及多余的Ba2+,然后进行过滤,除去 Mg(OH)2、BaSO4、CaC03等难溶物,最后加入适量的盐酸,除去多余的Na2C03和调节溶液的 pH。综上所述,正确的实验操作顺序为 C、D。
[例2]下列每组各有三对物质,它们都能用分液漏斗分离的是 ( )
A.乙酸乙酯和水,酒精和水,苯酚和水 B.二溴乙烷和水,溴苯和水,硝基苯和水
C.甘油和水,乙醇和水,乙酸和乙醇 D.油酸和水,甲苯和水,已烷和水
解析:两种互不相溶,密度也不相同的液体可以用分液漏斗分离。本题中不能相溶的物质有:乙酸乙酯和水,二溴乙烷和水,溴苯和水,硝基苯和水,油酸和水,甲苯和水,已烷和水。则能够用分液漏斗分离的是B、D组。
[例3]仅用水就能鉴别的一组物质是( )
A、苯、乙酸、四氯化碳 B、乙醇、乙醛、乙酸
C、乙醛、乙二醇、硝基苯 D、苯酚、乙醇、甘油
解析: 物质在水中的溶解性及溶于水时的热效应、液体的密度等性质,都可以作为鉴别一组物质的条件。如A项中乙酸能溶于水,而苯、四氯化碳难溶于水,但苯的密度比水小、四氰化碳的密度比水大,所以这三种物质可用水鉴别;B项中的三种物质都溶于水,所以这三种物质不可用水鉴别; C项中的乙醛、乙二醇都溶于水,所以这三种物质也不可用水鉴别;D项中的乙醇、甘油都溶于水,所以这三种物质同样也不可用水鉴别。答案: A.
[例1]贮气瓶中贮有有色气体,可能是由NO2、CH4、CO2、HCl、NH3、Br2(蒸气)等气体的几种混和而成。进行如实验:①通少许于水中得无色溶液;②通少许于AgNO3溶液中有白色沉淀生成;③通少许于澄清石灰水中,无浑浊现象;④通过盛水的洗气瓶后,再通入澄清石灰水中,石灰水变浑浊。则:
(1)由①可判断一定存在 ,一定不存在
(2)由②可判断一定存在 ,一定不存在
(3)由③④可判断一定存在 ,可能存在
解析:(1)有色气体为NO2、Br2(蒸气),二者溶于水后,前者呈无色,后者呈橙色。所以,一定存在NO2,一定不存在Br2(蒸气)。
(2)有色气体中的Br2(蒸气) 通入AgNO3溶液中会得到浅黄色沉淀,所以,一定存在NO2,一定不存在Br2(蒸气)。要得到白色沉淀,只能是HCl与AgNO3生成AgCl沉淀,因此一定含有HCl,但一定不能含有NH3。
(3)根据通过盛水的洗气瓶后的气体能使石灰水变浑浊这一现象,可推知一定存在CO2;但一开始通人澄清石灰水,无浑浊现象,可知必有酸性气体将CaCO3溶解,所以,可能存在NO2、HCl、Br2(蒸气)。
基础训练
1、基本概念:
鉴别:根据物质的特性对多种物质作区分性判断。
鉴定:对物质组成的元素、离子或原子团以及组成等相关的性质进行全方位的判断。
推断:通过对实验步骤和现象进行分析、推理、判断。
3、提纯的方法可归纳为:
杂转纯,杂变沉,化为气,溶剂分,即可将杂质除去。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com