
题目列表(包括答案和解析)
2、单质、氧化物在离子方程式中一律写化学式,如SO2与NaOH溶液反应的离子方程式:
SO2+2OH-=SO32-+H2O,生石灰与盐酸反应离子方程式:CaO+2H+=Ca2++H2O,与醋酸溶液反应离子方程式:Zn+2HAC=Zn2++2AC-+H2个
1、没有自由移动离子参加反应,不能写离子方程式
4、凡水解使溶液显酸性的阳离子与水解使溶液显碱性的阴离了不能大量共存。
(1)、常见水解使溶液显酸性的阳离子有:Al3+、Fe3+、NH4+。
(2)、常见水解使溶液显碱性的阴离子有:S2-、AlO2-、CO32-、HCO3--、PO43-
(3)、能相互发生氧化还原反应的离子不能大量共存:
(4)、常见还原性较强的离子有:Fe2+、S2-、I-、SO32-。
(5)、氧化性较强的离子有:Fe3+、ClO-、MnO4-、Cr2O72-、NO3-、此外,S2O32-与H+也不能共存(发生歧化反应)。
3、与OH-不能大量共存的离子有: NH4+和HS-、HSO3-、HCO3-、H2PO4-、HPO42-等弱酸的酸式酸根离子以及弱碱的简单阳离子(比如:Cu2+、Al3+、Fe3+、Fe2+、Mg2+等等)
2. 与H+不能大量共存的离子(生成水或弱电解质)酸及酸式弱酸根离子:
1)氧族有:OH-、S2-、HS-、SO32-、HSO3- 2)氮族有:H2PO4-、HPO42-、PO43-
3)卤族有:F-、ClO- 4)碳族有:CH3COO-、CO32-、HCO3-、SiO32-
5)含金属酸根离子:AlO2-
凡是能发生反应的离子之间或在水溶液中水解相互促进的离子之间不能大量共存(注意不是完全不能共存,而是不能大量共存)。一般规律是:
1. 凡相互结合生成难溶或微溶性盐的离子(熟记常见的难溶、微溶盐);
离子反应是指有离子参加的反应。也就是说,反应物中有离子或生成物中有离子的反应,均为离子反应。由于中学阶段涉及的问题多数是指水溶液中的变化,所以水溶液中电解质间的相互反应便成了离子反应的常见问题。但须注意的是,凡是离子化合物,就含有离子,有时固体状态的物质之间(如实验室制氨)或固体与气体之间(如碱石灰与氯化氢)发生的反应,也可以是离子反应,只是通常不书写类似这样过程的离子反应方程式。在水溶液中发生离子反应的条件即复分解反应的三个条件(有难电离、难溶及易挥发物质生成)和氧化还原反应(比如置换反应等)。
11.CH3CH2Br;CH3CH20H;NaBr;CH2=CH2;HBr;CH3CH3;Br2。
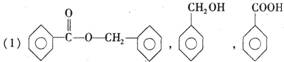
10.
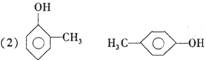
9.
(2)HCOOCH3 CH3COOH OHCCH2OH (3)(CO)nH2m(n≥1,m≥1,m、n为正整数。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com