
题目列表(包括答案和解析)
5. 某温度时,在体积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的线如下图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8)。下列正确的是
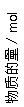
 A.该反应的化学方程式是3X+Y=2Z
A.该反应的化学方程式是3X+Y=2Z
B.有1mol Y消耗的同时有2mol Z生成,一定 到达平衡状态
C.达平衡时,c(Y)=0.7 mol·L-1
D.前1 min内,v(Z)=0.3 mol·L-1·min-1
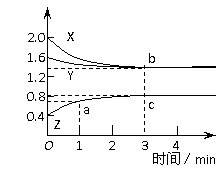
4.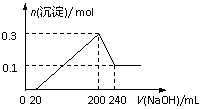 .将一定质量的镁和铝的混合物投入1000mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。若不考虑金属和盐酸反应时HCl的挥发,下列说法不正确是:
.将一定质量的镁和铝的混合物投入1000mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。若不考虑金属和盐酸反应时HCl的挥发,下列说法不正确是:
A.生成的氢气在标准状况下的体积为8.96L
B.0-20之间发生反应OH--+ H+ =H2O
C.NaOH溶液的物质的量浓度为4 mol•L-1
D.盐酸的物质的量浓度无法求出
3. 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中
加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中共转移的电子数为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
2. 用两支惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时,(设电解过程中阴极没有H2放出,且电解液在电解前后体积变化可以忽略不计)电极上析出银的质量最大为
A.27 mg B.54 mg C.106 mg D.216 mg
1. 电解100mL含 c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是
A.0.10mol/LAg+ B.0.02mol/L Zn2+
C.0.20mol/L Cu2+ D.0.20mol/L Pb2+
16、超细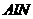 粉末被广泛应用于大规模集成电路生产领域。其制取原理为:
粉末被广泛应用于大规模集成电路生产领域。其制取原理为:
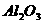 +
+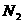 +3
+3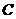 =2
=2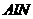 +3
+3 。由于反应不完全,
。由于反应不完全,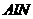 产品中往往含有炭和
产品中往往含有炭和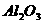 杂质。为测定该产品中有关成分的含量,进行以下试验:
杂质。为测定该产品中有关成分的含量,进行以下试验:
⑴称取10.00g样品,将其加入过量的 浓溶液中加热并蒸干,
浓溶液中加热并蒸干,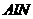 与
与 溶液反应生成
溶液反应生成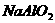 ,并放出3.36L(标准状况)
,并放出3.36L(标准状况)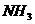 。
。
① 上述反应的方程式为_________________________
②
该样品中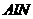 的质量分数为__________________
的质量分数为__________________
⑵另取10.00g样品置于反应器中,通入2.016L(标准状况)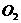 ,在高温下充分反应后测得气体的密度为1.34g/L(已折算为标准状况,
,在高温下充分反应后测得气体的密度为1.34g/L(已折算为标准状况,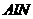 不跟
不跟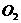 反应)。该样品中含杂质炭___g。
反应)。该样品中含杂质炭___g。
15、某无色溶液里,只含有下列8种离子的某几种: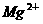 、
、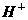 、
、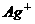 、
、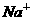 、
、 、
、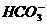 、
、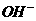 、
、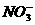 。已知该溶液能跟金属铝反应放出氢气,且放出的气体只有氢气。试回答:
。已知该溶液能跟金属铝反应放出氢气,且放出的气体只有氢气。试回答:
⑴若溶液跟铝反应后只有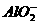 生成,则原溶液中一定含有的大量物质是(写化学式)
生成,则原溶液中一定含有的大量物质是(写化学式)
__________,发生反应的离子方程式:________________,还可能还有的大量物质是____
⑵若溶液跟铝反应后有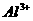 生成,则原溶液中一定不含有的大量离子是________
生成,则原溶液中一定不含有的大量离子是________
14、A、B、C、D是中学化学中常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,他们之间存在下图所示的转化关系:
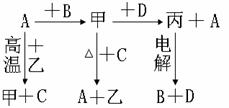
⑴元素A有可变化化合价,则单质A的名称为_______ 甲的化学式为__________ 乙的电子式为__________
⑵判断A和C的还原性强弱;A_____C(填<、>或=)
⑶写出甲和D反应的化学方程式(注明反应条件)_____________________
⑷已知D能与烧碱溶液反应,写出D与烧碱溶液反应的离子方程式:______________
13、某固体粉末含有下列钠盐中的三种:
A、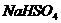 B、
B、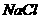 C、
C、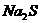 D、
D、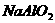 E、
E、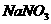 F、
F、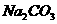
将固体溶于水中,有沉淀产生,同时有气体放出。根据上述现象推断该固体粉末的可能组成。(填写相应字母,可不填满,也可补充)
第一种情况:_________________ 第二种情况:___________________________
第三种情况:_________________ 第四种情况:___________________________
(一)、选择题:
1、第ⅡA族的铍在一定条件下可形成化合物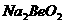 。下列有关铍及其化合物的叙述正确的是:
。下列有关铍及其化合物的叙述正确的是:
A、氧化铍不溶于盐酸 B、氢氧化铍易溶于水
C、单质铍与 溶液反应生成
溶液反应生成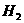 D、
D、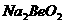 溶液呈酸性
溶液呈酸性
2、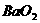 和
和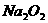 都是离子化合物,下列叙述正确的是:①
都是离子化合物,下列叙述正确的是:①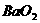 和
和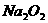 都能跟水反应放出
都能跟水反应放出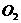 ;②
;②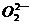 离子的电子式是
离子的电子式是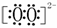 ;③
;③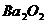 在水中以
在水中以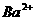 和
和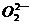 形式存在;④
形式存在;④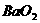 的熔点可能低于100℃
的熔点可能低于100℃
3、向100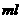 的
的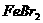 溶液中通入标准状况的
溶液中通入标准状况的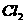 3.36L,全部被还原,测得溶液中
3.36L,全部被还原,测得溶液中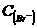 =
=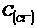 ,则原
,则原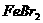 溶液的物质的量浓度:
溶液的物质的量浓度:
A、0.75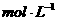 B、1.5
B、1.5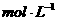 C、2
C、2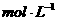 D、3
D、3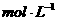
4、等体积,等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两个烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲乙两个烧杯中的反应情况可能分别是:
A、甲乙中都是铝过量 B、甲中铝过量,乙中碱过量
C、甲中酸过量,乙中铝过量 D、甲中酸过量,乙中碱过量
5、将3.5g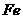 、
、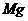 合金投到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标况下的气体V L(
合金投到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标况下的气体V L(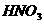 被还原为
被还原为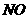 和
和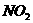 ),若向反应后的溶液中加入足量的
),若向反应后的溶液中加入足量的 溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称量质量为8.6g。则收集到气体的体积V值可能为:
溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称量质量为8.6g。则收集到气体的体积V值可能为:
A、1.12 B、5.34 C、7.26 D、8.23
6、将溶液中的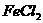 (0.1
(0.1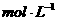 )氧化成
)氧化成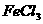 ,为不引入其他杂质,下列试剂最合适的是:
,为不引入其他杂质,下列试剂最合适的是:
A、浓硫酸 B、稀硝酸 C、双氧水 D、氯水
7、单质A能从盐溶液中置换出单质B,则下列说法不正确的是:
A、当A、B都是金属时,A一定比B活动性强
B、A、B都是非金属时,A一定比B活动性强
C、当A是金属时,B可能是金属,也可能是非金属
D、当A是非金属时,B可能是金属,也可能是非金属
8、在含有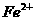 、
、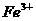 、
、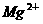 、
、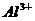 的溶液中,加入足量
的溶液中,加入足量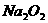 固体,充分作用后,再加入过量稀盐酸,溶液中离子数目没有变化的是:
固体,充分作用后,再加入过量稀盐酸,溶液中离子数目没有变化的是:
A、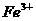 B、
B、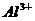 C、
C、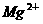 D、
D、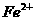
9、将一定量的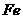 、
、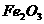 、
、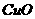 的混合物放入体积为100
的混合物放入体积为100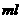 。浓度为2.2
。浓度为2.2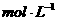 的硫酸溶液中,充分反应后生成气体896
的硫酸溶液中,充分反应后生成气体896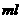 (标准状况),得到不溶固体1.28g,过滤后,滤液中的金属离子只有
(标准状况),得到不溶固体1.28g,过滤后,滤液中的金属离子只有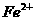 (假设滤液体积仍为100
(假设滤液体积仍为100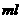 )。向滤液滴加2
)。向滤液滴加2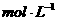 的
的 溶液前滤液中
溶液前滤液中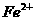 物质的量浓度为:
物质的量浓度为:
A、2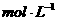 B、1.8
B、1.8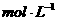 C、1.9
C、1.9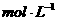 D、无法计算
D、无法计算
10、下列说法中不正确的是:
A、人类历史上使用最早的合金是青铜,目前世界上使用量最大的合金是钢
B、从金属矿石中提炼金属的一般步骤依次是:矿石的富集、精炼、冶炼
C、硫酸的消费量常被视为一个国家工业发达水平的一种标志
D、能源、信息、材料通常被称为新科技革命的三大支柱
11、现有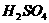 、
、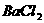 、
、 、
、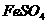 和氯水五种溶液,有如下图所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是:
和氯水五种溶液,有如下图所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是:
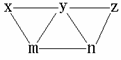 A、x一定为
A、x一定为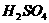 B、y一定为
B、y一定为
C、z可能为氯水 D、m、n必定各为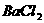 、
、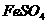 中的一种
中的一种
12、某学生为测定a、b、c、d、e五种金属的活动性顺序,做如下试验:①取少量上述五种金属投入到足量盐酸中,发现a、c、e溶解;②将上述反应液过滤,往滤液中加过量稀烧碱溶液时,发现加a的滤液中产生白色沉淀,加c的滤液中先有白色胶状物生成后又溶解,加e的滤液中白色沉淀很快变灰绿色最后变红褐色;③再将a、c两种金属片用导线连接,金属片插入盛有稀硫酸的烧杯中,c金属片上有大量气泡逸出;④用直流电电解含b、d阳离子的混合液,在阴极上首先析出d金属。根据以上试验,五种金属活动性由强到弱的顺序可能是:
A、a>c>e>b>d B、c>a>e>d>b C、a>c>e>d>b D、d>b>e>a>c
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com