
题目列表(包括答案和解析)
21. 在一定条件下,NanRO3和NaI在硫酸介质中反应,发生反应生成NaR、I2和Na2SO4。已知该变化过程中,0.1mol的NanRO3参加反应时共转移0.6mol电子:
(1)RO3n-中R元素的化合价是 ;
(2)R元素的最外层电子数为 ;
(3)写出该反应配平的离子方程式。
20. FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为4﹕1﹕4时,实际参加反应的FeS与HNO3的物质的量之比为
A.1∶6 B.2∶15 C.2∶3 D.16∶25
19. 在一定体积pH =1的HCl与HNO3的混合溶液中,逐滴加入c mol·L-1的AgNO3溶液,当溶液中的Cl-恰好完全沉淀时,溶液pH =2。若反应后溶液的体积等于反应前两溶液体积之和,则原溶液中NO3-的物质的量浓度(mol·L-1)是
A.0.1c B.9c C.0.1-9c D.0.1-0.9c
18. 若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1乙醇溶液的质量分数,且知2ω1=ω2,则下列推断正确的是(乙醇的密度比纯水的小)
A a<b<2a B 2b=a C b>2a D 2a=b
17. 强酸和强碱稀溶液的中和热可表示为 H+(aq)+OH-(aq)=H2O(l);
△H=-57.3kJ·mol1
已知:①HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ·mol-1
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=-b kJ·mol-1
③HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=-c kJ·mol-1
则a、b、c三者的大小关系为
A.a>b>c B.b>c>a C.a=b=c D.无法比较
16. 有镁、铝合金14.7g,全部溶于500mL6.0mol/L的盐酸中充分反应后,再加400mL8.0mol/L的NaOH溶液,结果得到沉淀26.3g,则合金中镁、铝的质量分别为
A.13.5g和1.2g B.10 .2g和4.5g
C.1.2g和13.5g D.10.9g和3.8g
15. Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为1︰2,则反应中被氧化的Cl2与被还原的Cl2的物质的量之比为
A、2︰3 B、4︰3 C、10︰3 D、3︰11
14. 24g石英和80g石灰石在高温下充分反应,放出的气体在标准状况下的体积是
A.4.48L B.8.96L C.11.2L D.17.92L
13. 1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为
A.-Y kJ/mol B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol
12. 恒温、恒压下,a molA和b molB在一个容积可变的容器中发生如下反应:
A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b-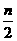 )
)
C.若起始时放入2a molA和2b molB,则达平衡时生成2n molC
D.当v正(A)=2v逆(B)时,可确定反应达平衡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com