
题目列表(包括答案和解析)
1. 由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1, c(SO42-)=0.8mol·L-1,则c(K+)为:
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
10.已知:2Fe3+ + 2I- = 2Fe2+ + I2 2Fe2+ + Br2 = 2Fe3+ + 2Br-(不考虑氯气与I2的反应)
(1)含有1molFeI2和2molFeBr2的溶液中通入2molCl2,此时被氧化的离子是 ,
被氧化的离子的物质的量分别是 。反应的离子方程式为
。
(2)如果向含有1molFeI2和2molFeBr2的溶液中通入3molCl2,则被氧化的离子是 ,其对应的氧化产物的物质的量分别是 。反应的离子方程式为
。
(3)若向含有amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Br-、Fe2+完全被氧化时,c为
(用含a、b的代数式表示)
9. 1986年,人们成功的用如下反应制得了氟:
①2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2
②K2MnF6+2SbF5=2KSbF6+MnF4
③2MnF4=2MnF3+F2↑
下列说法中正确的是
A.反应①、②、③都是氧化还原反应
B.反应①H2O2既是还原剂又是氧化剂
C.氧化性:KMnO4>O2
D.每生成1mol F2,上述反应共转移2mol电子
8. 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程为:
2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O
干法制备的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是
A.高铁酸钾中铁显+6价
B.湿法中每生成1 mol Na2FeO4转移3 mol电子
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
7.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O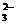 +O2+xOH-
+O2+xOH- Fe3O4+S4O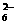 +2H2O,下列说法中,正确的是
+2H2O,下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为3mol
B.Fe2+和S2O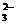 都是还原剂
都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.可能有多组配平系数
6. 工业废气的氮氧化物(NO、NO2等,用通式NOx表示)是主要的大气污染物之一。为了保护环境,工业上常通入氨气与之发生反应:NOx+NH3→N2+H2O。有关此反应,下列说法中错误的是
A.无论x何值,N2既是氧化产物又是还原产物
B.当x=1时,每生成2.5 mol N2,被氧化的气体有2 mol
C.当x=2时,有1 mol气体被还原,转移的电子为4 mol
D. 当x=2时,反应通式配平后H2O的化学计量数为8
5. 将适量的SO2通过入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的元素是
A. S B. Fe C. Cl D. N
4. 已知氧化还原反应: 2Cu(IO3)2 + 24KI + 12H2SO4 = 2CuI↓ + 13I2 + 12K2SO4 + 12H2O其中 1mol氧化剂在反应中得到的电子为
A.10mol B.11mol C.12mol D.13mol
3.已知下列物质都能氧化H2S,它们氧化H2S时自身分别发生下列变化:Fe3+→Fe2+,Cr2O72-→2Cr3+,Br2→2Br-,HNO3→NO。如要氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最小的是
A.Fe3+ B.Br2 C.Cr2O72- D.HNO3
2.根据下列反应判断有关物质还原性由强到弱的顺序是
①H2SO3 + I2 + H2O = 2HI + H2SO4
②2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
③3FeCl2 + 4HNO3 = 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com