
题目列表(包括答案和解析)
3.在实验室制得1ml乙酸乙酯后,沿器壁加入0.5ml紫色石蕊试液,这时石蕊试液将存在于饱和碳酸钠层与乙酸乙酯层之间(整个过程不振荡)。对可能出现的现象,下列叙述正确的是:
A. 液体分两层,石蕊层仍呈紫色,有机层呈无色
B. 石蕊层为三层环,由上而下呈蓝、紫、红色
C. 石蕊层有两层,上层呈紫色,下层呈蓝色
D. 石蕊层为三层环,由上而下呈红、紫、蓝色
2.有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有
A. 8种 B. 14种
C. 16种 D. 18种
1.下列各组物质中各有两组分,两组分各取1 mol,在足量氧气中燃烧,两者耗氧量不相同的是
A. 乙烯和乙醇 B. 乙炔和乙醛
C. 乙烷和乙酸甲酯 D. 乙醇和乙酸
7. 2007年10月是索尔维制碱法命名140周年纪念,1867年在巴黎世界博览会上,将氨碱法正式命名为索尔维制碱法。该法广泛为世界各国采用,后被中国的侯氏制碱法所取代。索尔维法的生产流程是:

索尔维法能实现连续生产,但食盐利用率只有70﹪,且副产品CaCl2没有用途,污染环境。
1940年我国化学家侯德榜先生经过多次实验,冲破了“索尔维法”的技术封锁,并加以改进,食盐利用率达96﹪,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”。其基本原理是:
①在30℃-50℃的饱和食盐水中,先通入氨饱和,再通入CO2得碳酸氢钠沉淀。
②过滤,将滤渣加热而得副产品。
③在滤液中加入细食盐末,在10℃-15℃,使NH4Cl沉淀,过滤,滤液为饱和食盐水。
请完成下列问题:
(1)在氨的饱和NaCl溶液中通入CO2的两步反应方程式:
______ ___________。
(2)不能在NaCl溶液中通入CO2制NaHCO3的原因是____________________。
(3)析出小苏打的母液中加入生石灰的反应方程式:_______________。
(4)在“侯氏制碱法”中,_______物质可以循环利用,在“索尔维法”中___________物质可以循环利用。
(5)“侯氏制碱法”与“索尔维”相比,其优点是___________。
6.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学反应方程式为:5KclO3+6P=3P2O5+5KCl,则下列有关叙述错误的是( )
A.上述反应中氧化剂和还原剂的物质的量之比为5:6
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中
的水分,生成磷酸小液滴(雾)
C.上述反应中消耗3molP时,转移电子的物质的量为15mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
5.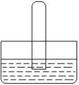 常温下,下列各组气体等体积混合,充满试管倒立在水槽中,试管内气体体积不会明显减少的一组是( )
常温下,下列各组气体等体积混合,充满试管倒立在水槽中,试管内气体体积不会明显减少的一组是( )
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
NO、O2 |
C2H4、H2 |
NO2、O2 |
Cl2、SO2 |
NH3、O2 |
CO、O2 |
A. ③ ⑤ B.② ④ C. ② ⑥ D.① ③
4. 取xg铜和镁的合金完全溶于浓硝酸,若反应中硝酸被还原只产生8960mL的NO2气体和672mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为17.02g,则x等于( )
A.8.64g B.9.00g C.9.20g D.9.44g
3.英国研究人员2007年8月30日发表报告认为,全球将有1.4亿人因为用水而受到砷中毒之害,导致更多的人患癌症海带含砷超标,经水浸泡24小时后,其含砷量才能达到食用安全标准,下列对砷(As)的有关判断正确的是( )
A.砷原子序数为33,它与铝为同主族 B.砷的原子半径小于磷的原子半径
C.砷化氢的稳定性比溴化氢的强 D.砷酸的酸性比硫酸的弱
2. 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有HF、NO和HNO3。则下列说法错误的是
A.反应过程中,被氧化与被还原的元素的物质的量之比为1:2
B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉
C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染
D.若反应中生成1.0 mol NO,转移的电子数目为6.02×1023
1. 膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之。它的分子是三角锥形。以下关于PH3的叙述正确的是( )
A.PH3是极性键构成的非极性分子 B.PH3分子中存在未成键的电子对
C.PH3是一种强氧化剂 D.PH3比NH3更稳定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com