
题目列表(包括答案和解析)
5、一定温度下,可逆反应H2(g)+I2(g)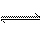 2HI(g)达到化学平衡状态的标志是( )
2HI(g)达到化学平衡状态的标志是( )
A、混合气体的压强不再变化 B、混合气体的颜色不再变化
C、反应速率v(H2)=0.5v (HI) D、c(H2):c(I2):c(HI)=1:1:2
4、对可逆反应4NH3(g) + 5O2(g) 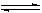 4NO(g) + 6H2O(g),下列叙述正确的是( )
4NO(g) + 6H2O(g),下列叙述正确的是( )
A.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
B.达到化学平衡时,4v正(O2) = 5v逆(NO)
C.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
D.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
3、反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间
2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间
内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为( )
A、0.1s B、2.5s C、5s D、10s
2、将 2 mol A 气体和 4 mol B 气体在 2 L
的容器中混合并在一定条件下发生如下反应:2A(气)+B(气) 2C(气);若经 2s(秒)后测得C的物质的量为0.6mol ,现有下列几种说法:① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1 ② 用物质 B 表示的反应的平均速率为 0.075mol·L-1·s-1 ③ 2s 时物质 A 的转化率为30%④ 2s 时物质 B 的浓度为 0.85 mol·L-1,其中正确的是( )
2C(气);若经 2s(秒)后测得C的物质的量为0.6mol ,现有下列几种说法:① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1 ② 用物质 B 表示的反应的平均速率为 0.075mol·L-1·s-1 ③ 2s 时物质 A 的转化率为30%④ 2s 时物质 B 的浓度为 0.85 mol·L-1,其中正确的是( )
A、①③ B、①④ C、②③ D、③④
1、反应 4NH3(g)+5O2(g)
 4NO(g)+6H2O(气g在2L的
密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
4NO(g)+6H2O(气g在2L的
密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
A、NO: 0.0008mol/L B、H2O: 0.002mol/L C、NH3 : 0.002mol/L D、O2: 0.00125mol/L
24、将质量分数为8.8%的NaOH溶液1L(密度为1.06g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了1.0%时停止电解,则此时溶液中应符合的关系是( )
|
|
NaOH的质量分数 |
阳极析出物的质量/g |
阴极析出物的质量/g |
|
A |
9.8% |
19 |
152 |
|
B |
9.8% |
152 |
19 |
|
C |
7.8% |
1.2 |
9.4 |
|
D |
7.8% |
9.4 |
1.2 |
23、用铁做阴极,石墨做阳极电解1LAgNO3溶液中,当电极上析出银的质量为是1.08g时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),则电解液的pH将从6大约变为( ) A.1 B.2 C.3 D.4
22、用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL  KCl溶液和
KCl溶液和
 的
的 溶液,当产生
溶液,当产生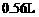 (标准状况)
(标准状况)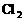 时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500mL)
时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500mL)
A、1.4 B、5.6 C、7 D、12.6
21.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知,氧化性:Fe2+<Ni2+<Cu2+) ( )
A、 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B、电解过程中,阳极质量的减少与阴极质量的增加相等
C、电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D、电解后,电解槽底部的阳极泥中只有Cu和Pt
20、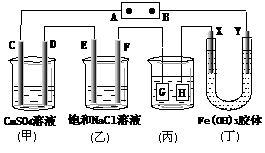 如下图所示的装置,C、D、E、F、X、Y都是
如下图所示的装置,C、D、E、F、X、Y都是
惰性电极。将电源接通后,向(乙)中滴入酚酞
溶液,在F极附近显红色。则以下说法正确的是( )
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质
生成,其物质的量比为1∶2∶3∶2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液选是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com