
题目列表(包括答案和解析)
3.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
A.放电时负极反应为:3Zn -6e-+6OH- == 3Zn(OH)2
B.放电时正极反应为:2FeO42-+6e-+8H2O===2Fe(OH)3+10OH-
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性减弱
2.下列叙述不正确的是( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
B.白铁(镀锌铁)镀层破损后,先被腐蚀的是铁
C.钢铁表面常易锈蚀生成Fe2O3·nH2O
D.金属的腐蚀主要是电化学腐蚀
1.下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
9. 硫化氢的水溶液中有如下动态平衡:H2S H+ + HS- HS-
H+ + HS- HS-  H+ + S2-
H+ + S2-
H2O H+ +OH-,在物质的量浓度为0.1mol·L-1的H2S溶液中,下列各离子间的关系正确的是
H+ +OH-,在物质的量浓度为0.1mol·L-1的H2S溶液中,下列各离子间的关系正确的是
A. c(H+) = c(HS-) + 2c(S2-) + c(OH-)
B. 2c(H+) = 2c(HS-) + c(S2-) +2c(OH-)
C. c(H+) = C(HS-) +2c(S2-)
D. c(H+) = 2c(S2-) +c(OH-)
8. 甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知( )
A.a的浓度必小于乙酸的浓度 B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度 D.b的浓度必大于乙酸的浓度
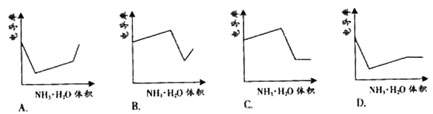
7. 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是
6. 已知某溶液中存在 ,
,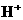 ,
, 和
和 四种离子,其浓度大小有如下关系,其中可能的是
(
)
四种离子,其浓度大小有如下关系,其中可能的是
(
)
①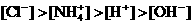 ②
②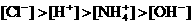
③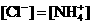 且
且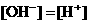 ④
④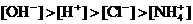
⑤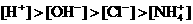
A.①④ B.③⑤ C.①②③ D.④⑤
5.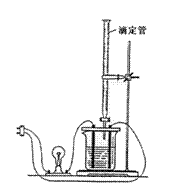 利用右图装做下面的实验:在烧杯里盛半杯乙溶液,
利用右图装做下面的实验:在烧杯里盛半杯乙溶液,
然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入
甲溶液,电灯又会逐渐亮起来。下列各组溶液中
(甲在前,乙在后),能够产生上述现象的是( )
A.NH3·H2O、AgNO3
B.CH3COOH、NH3·H2O
C.NaOH、AlCl3
D.H2SO4、Ba(OH)2
4. 0.1mol/L的CH3COONa溶液和0.1mol/L的盐酸等体积混合后,溶液中离子浓度关系符合实际的是
A.c(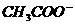 )>c(CH3COOH)
)>c(CH3COOH)
B.c(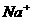 )+c(
)+c(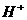 )=c(
)=c(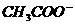 )+c(
)+c( )
)
C.c(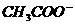 )+c(
)+c(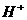 )>c(
)>c( )
)
D.c(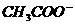 )+c(CH3COOH)=c(
)+c(CH3COOH)=c(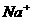 )
)
3. 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
A.加少量烧碱溶液 B.降低温度
C.加少量冰醋酸 D.加水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com