
题目列表(包括答案和解析)
7.同素异形体是 。
6.同位素是 。
5.比较元素和原子的区别
4.元素是 。
元素存在形式 。
思考:质子数相同的微粒一定是同一种元素吗?
3.离子是 。
2.分子是 。
思考:是否可理解为分子是保持物质性质的微粒?
1.原子是 。
思考:为什么说原子是化学变化中的最小微粒?能否理解为原子是构成物质的最小微粒?
V气体(标准状态)(L)

 粒子数(N)
物质的量(n)
物质的质量(g)
粒子数(N)
物质的量(n)
物质的质量(g)
V溶液(L)
请你将上述关系图的转化方法标出来。
试题枚举
[例1]如果我们规定12C的相对原子质量为24,且0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),那么下列几种物理量会有变化吗?若有,请说明变化结果。
(1)一个12C原子的质量 (2)阿伏加德罗常数(NA) (3)摩尔质量
(4)O2的相对分子质量 (5)气体摩尔体积 (6)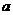 g C2H5OH的物质的量
g C2H5OH的物质的量
(7)98%(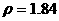 )硫酸的物质的量浓度
(8)44gCO2所含的分子个数
)硫酸的物质的量浓度
(8)44gCO2所含的分子个数
解析:(1)在规定12C的相对原子质量为24时,实际上是把作为相对原子质量的标准从原来用12C质量的1/12,改为1/24,但是单个碳原子的质量并没有因此而发生改变;
(2)原来是以0.012kg12C所含有的碳原子数作为阿伏加德罗常数(即6.02×1023),现在用0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),很明显0.024kg12C中所含的原子个数是0.012kg12C中所含的原子个数的2倍;故阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023);
(3)原来所称摩尔质量,实质上是指1摩尔物质的质量即6.02×1023个微粒集体的质量,当作出了上述规定后,1摩尔所含的粒子数已经变成了原来的2倍,故其质量也就为原来的2倍;
(4) 原来氧分子的相对分子质量=氧分子的质量/12C质量的1/12,现在氧分子的相对分子质量=氧分子的质量/12C质量的1/24,即作为相对原子质量的标准变为了原来的一半,而氧分子的质量是固定的,故氧分子的相对分子质量变为原来的2倍;
(5)气体摩尔体积是指在一定的温度和压强下, 阿伏加德罗常数个气体分子所占有的体积,由于阿伏加德罗常数已经变成了原来的2倍,气体摩尔体积当然也就是原来的2倍了;
(6)根据公式:物质的量(n)=物质的质量(m)/物质的摩尔质量(M),在新的条件下由于摩尔质量变成了原来摩尔质量的2倍,等质量的物质的“物质的量”则等于原来的一半;
(7)
溶质的物质的量浓度(CB)=溶质的物质的量(n)/溶液的体积(V),在单位体积的98%(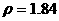 )硫酸中所含溶质--硫酸的质量是不变的,但由(6)中所述可知,其物质的量(n)变成了原来的一半,故物质的量浓度变为原来的0.5倍;
)硫酸中所含溶质--硫酸的质量是不变的,但由(6)中所述可知,其物质的量(n)变成了原来的一半,故物质的量浓度变为原来的0.5倍;
(8) 不论作为相对原子质量的标准如何变化,单个CO2分子的质量并未变化,故一定质量的CO2所含的分子个数是不会发生变化的。
答案:(1)不变(2)变为原来的2倍(3)变为原来的2倍(4)变为原来的2倍(5)变为原来的2倍(6)变为原来的0.5倍(7)变为原来的0.5倍(8)不变
[例2]下列说法中,正确的是( )
A.KOH的摩尔质量是56g B.一个碳原子的质量就是其相对原子质量
C.硫原子的质量就是硫的相对原子质量
D.氦气的摩尔质量在数值上等于它的相对原子质量
解析:摩尔质量的单位应当是g/mol,而不是g,故A不对;碳原子的相对原子质量是指拿一个碳原子质量除以一个12C原子质量的1/12所得的比值;硫原子的质量除以一个12C原子质量的1/12所得的比值才是硫的相对原子质量,所以B、C均不对;
答案D
[变式]在一定条件下,16g A和20g B恰好反应生成4.5g D和C。在相同条件下,8g A与15g B反应可生成0.125mol C和D。从上述事实中可推知C的分子量为 。
解析: 根据质量守恒定律可知,16g A和20g B恰好反应时生成4.5g D和31.5gC;在相同条件下,8g A与15g B反应(根据上述反应中A和B的比例关系可知B是过量的)时则应当生成 15.75gC,题目给出的是生成0.125mol C,根据摩尔质量(M)=物质的质量(g)/物质的“物质的量(n)”,可以计算出M=126g/mol,所以C的相对分子质量为126。
[例3]用NA表示阿佛加德罗常数,下列说法中正确的是( )
A.1mol甲烷的质量与NA个甲烷分子的质量之和相等
B.28g氮气与40g氩气所含的原子数目相等,都是NA个
C.2.3g钠由原子变成离子,失去的电子数为0.1NA
D.18g重水(D2O)所含的电子数为10NA
解析:]根据摩尔的定义,每摩尔物质含有阿伏加德罗常数(NA)个微粒,所以A组答案是正确的,氮气是双原子分子,而氩气是单原子分子,28g氮气所含有的原子数为2NA个,40g氩气所含的原子数目是NA个;一个钠由原子变成离子时,将会失去1个电子,2.3g钠为0.1mol,由原子变成离子时失去的电子数为0.1NA;18g重水(D2O)所含的分子为0.9mol,而每个分子所含的电子数为10个,所以18g重水(D2O)所含的电子数为9NA;故答案为AC
[变式](1)(NH4)2SO4的摩尔质量为 。现有26.4g(NH4)2SO4,则其中含有 molH, 个氧原子、 mol质子;它溶于水时能电离产生 mol铵根离子,这么多铵根离子的质量是 。
(2)计算10克下列物质的“物质的量”(保留小数点后两位)
NaHCO3 SO3
(3)计算出下列物质的质量0.2mol Na2CO3 ;0.3mol NH4HCO3
(4)26.4g(NH4)2SO4中硫元素的质量与 g NaHCO3中所含氧元素的质量相等;与 g NaHCO3中所含的氢原子个数相等。
[例4]有一真空储气瓶,净重500克。在相同条件下,装满氧气后重508克,装满另一种气体X时重511克,则X的相对分子质量为( )
A. 44 B. 48 C. 64 D. 71
解析:本题题给条件应当说是“同温、同压、同体积(同一个真空瓶)”,所以不论装什么气体,里面所含气体的物质的量是相同的,根据物质的量(n)=物质的质量(m)/物质的摩尔质量(M)可以得到计算式:(508-500)/32=(511-500)/ M,所以M=44。
答案:A
[变式]标准状况下,mg气体A与ng气体B所含分子数相同,下列说法不正确的是
A. A与B相对分子质量之比为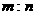
B. 同质量的A与B所含分子数之比为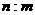
C. 相同状况下,同体积的A与B的质量之比为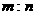
D. 标准状况下,A与B的密度之比为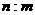
答案:D
[例5]配制250 mL 1.6mol/L NaCl溶液。具体步骤如下:
(1)计算:需 gNaCl。(2)称量:使用的主要仪器是 。
(3)溶解:将称好的NaCl放在 中加适量蒸馏水溶解,并用 加以搅拌。
(4)转移:待溶液冷却到室温后,将其沿玻璃棒注入 中,其中玻璃棒的作用是 。
(5)洗涤:将烧杯和玻璃棒用蒸馏水洗涤 次,并将每次洗涤后的溶液都注入中;其主要目的是 。
(6)定容:将蒸馏水注入 中,直到其中液面接近其刻度 处时,改用 滴加蒸馏水至溶液的 液面正好与刻度线相切。将瓶塞子盖好,反复上下颠倒、摇匀。
[变式1]在配制物质的量浓度溶液时,下列操作出现的后果是(填:“溶液浓度不准确”、“偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,溶液不能澄清,溶质少量不溶解。____________。
(3)配制氯化钠溶液时,容量瓶中有少量水。______________。
(4)定容时,液面上方与刻度相齐时,停止加水。__________。
(5)配制好溶液后,容量瓶未塞好,洒出一些溶液。_____________。
(6)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线____________。
答案:(1)偏低 (2)偏低 (3)无影响 (4)偏高 (5)无影响 (6)偏低
[变式2]实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取的Na2CO3质量分别为( )
A. 1000mL , 212g B. 950mL , 201.4g C. 500mL , 286g D. 1000mL, 201.4g
解析:由于容量瓶的规格中不可能有950mL,只能选择略大于所需溶液体积的规格(即1000mL),计算溶质的质量时也就按1000mL溶液中所含的溶质。
答案:A
6.以单位 溶液里所含 B的 来表示溶液组成的物理量,叫B的物质的量浓度。符号为 ,常用的单位是 (或 )。
[课堂练习]
(1)2gNaOH溶于水配制成 mL溶液时其物质的量浓度为2mol/L。
(2)现欲配制200mL0.2mol/L Na2SO4溶液,则需要用 mL 1mol/L的Na2SO4溶液加水稀释而成。从稀释而成的溶液中取出10 mL则其中含有的钠离子是 个。
(3)把2.24LHCl气体溶于水,配制成250mL溶液,则该溶液的物质的量浓度为 ,若其密度为1.1g/mL,则其溶质的质量分数是 %。
5.在相同的 和 下,相同体积的任何 都含有 的粒子。
[讨论]下列有关气体的叙述中,错误的是( )
A. 不同的气体,若体积不同,则它们所含的分子数肯定不同
B.当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离
C. 一定温度和压强下,气体分子的物质的量决定了它们的体积
D.
在标准状况下,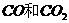 的混合物
的混合物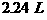
[课堂练习](1)标准状况下:22g CO2的体积是 ,其中所含分子数与 gO2相同。
(2)0.01 mol某气体的质量是0.28g,该气体的摩尔质量是 ;在标准状况下,
该气体的密度是 。
(3)相同条件下,CH4与O2的质量比是1:8时二者的体积比是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com