
题目列表(包括答案和解析)
2.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110 ℃-140 ℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
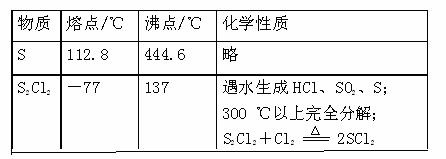
设计实验装置图如下:
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见______________________________________________ __
______________________________________________________________。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式___________________________________;
E中反应的化学方程式____________________________________。
(3)C、D中的试剂分别是______________、_____________。
(4)仪器A、B的名称是__________、___________,F的作用是____________________________。
(5)如果在加热E时温度过高,对实验结果的影响是___________________________, 在F中可能出现的现象是_________________________________________________。
(6)S2Cl2粗品中可能混有的杂质是(填写两种)_____________、____________,为了提高S2Cl2的纯度,关键的操作是控制好温度和___________________________________。
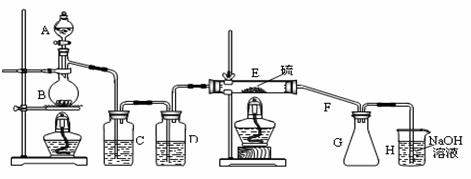
1.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网c.泥三角d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、___ __、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是:
、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
(1)不同类型的晶体:一般而言,熔、沸点高低顺序为原子晶体>离子晶体和金属晶体>分子晶体
(2)同类晶体:
①原子晶体的熔、沸点取决于共价键的键长和键能,键长越短、键越大,熔、沸点越高,如金刚石>金刚砂>晶体硅
②离子晶体的熔、沸点取决于离子键的强弱,通常离子半径越小、离子所带电荷数大,离子键越强,熔、沸点高,如KF>KCl>KBr、NaCl>KCl;
晶格能是指 形成1摩离子晶体释放的能量,通常取正值,晶格能越大,形成的离子晶体越 ,且熔沸点
③分子晶体的熔、沸点取决于分子间作用力的大小,通常分子极性越强、相对分子质量越大,分子间作用力越强,熔、沸越高,有氢键的分子晶体,还要考虑氢键的强弱
④同类金属晶体中,金属离子半径越小,阳离子带电荷数越高,金属键越强,熔、沸点越高,如Li>Na>K, Na<Mg<Al
试题枚举
[例1]晶体具有各向异性。如蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的导电率与层平行的方向上的导电率1∕104。晶体的各向异性主要表现在是:( )
①硬度 ②导热性 ③导电性 ④光学性质
A.①③ B.②④ C.①②③ D.①②③④
答案:D
[例2]下列属于分子晶体的一组物质是
A. CaO、NO、CO B .CCl4、H2O2、He
C .CO2、SO2、NaCl D .CH4、O2、Na2O
解析:固态金属是金属晶体;大多数的盐、碱和金属氧化物是离子晶体;熟记常见的原子晶体;其它常见物质大多是分子晶体
答案:B。
[例3]下列性质符合分子晶体的是
A . 熔点1070℃,易熔于水,水溶液能导电
B. 熔点是10.31℃,液体不导电,水溶液能导电
C. 熔点97.81℃,质软,能导电,密度是0.97g/cm3
D. 熔点973℃,熔化时能导电,水溶液也能导电
解析:A、D中的物质熔点较高,D中物质熔化时能导电,都是离子化合物;C中物质固态能导电,应为金属单质
答案:B
[例4]下列大小关系正确的是( )
A.晶格能:NaCl<NaBr B.硬度:MgO>CaO
C.熔点:NaI>NaBr D.熔沸点:CO2>NaCl
解析:离子半径 Cl-<Br- 离子键 NaCl>NaBr,晶格能NaCl>NaBr,A项错误;MgO、CaO均为离子晶体,离子半径Mg2+<Ca2+,MgO中离子键强,键能大,晶格能大,硬度大,B正确;C类似;D中CO2分子晶体,NaCl是离子晶体,熔沸点:CO2<NaCl
答案:B
[例5]金属能导电的原因是
A. 金属晶体中金属阳离子与自由电子间的相互作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
解析:金属晶体中金属阳离子与自由电子间的相互作用属于静电作用,是强烈的相互作用,A错误;金属晶体在外加电场作用下电子定向移动,不会失去。
答案:B
[例6]现有甲、乙、丙、丁四种晶胞(如图所示),可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体的化学式为______。
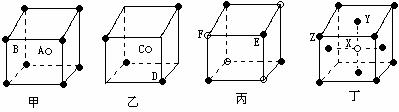
解析:立方晶胞体心的微粒一个晶胞所有,面心的微粒为两个晶胞是共有,每个微粒有1/2属于该晶胞,棱边的微粒为4个晶胞共有,每个微粒有1/4属于该晶胞,顶点的微粒为个8晶胞共有,每个微粒有1/8属于该晶胞。
答案:1∶1 C2D EF XY3Z
2.常见晶体的结构
 在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是
结构,两个碳碳单键的键角为
,其中的碳原子采取 杂化,金刚石晶体中C原子数与C-C键数之比为 ,晶体中最小的环上上的碳原子数为 ;石墨晶体中C原子数与C-C键数之比为
;NaCl晶体中Na+的配位数为 ,Cl-的配位数为 ,每个Na+的周围距离最近且相等的Na+的个数为 ,CsCl晶体中Cs+的配位数为 ,Cl-的配位数为 ,每个Cs+的周围距离最近且相等的Cs+的个数为 ;二氧化硅晶体中每个硅原子与 个氧原子相连,在二氧化硅晶体中最小的环中有 个原子,1mol二氧化硅晶体中,Si-O的数目为 。
在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是
结构,两个碳碳单键的键角为
,其中的碳原子采取 杂化,金刚石晶体中C原子数与C-C键数之比为 ,晶体中最小的环上上的碳原子数为 ;石墨晶体中C原子数与C-C键数之比为
;NaCl晶体中Na+的配位数为 ,Cl-的配位数为 ,每个Na+的周围距离最近且相等的Na+的个数为 ,CsCl晶体中Cs+的配位数为 ,Cl-的配位数为 ,每个Cs+的周围距离最近且相等的Cs+的个数为 ;二氧化硅晶体中每个硅原子与 个氧原子相连,在二氧化硅晶体中最小的环中有 个原子,1mol二氧化硅晶体中,Si-O的数目为 。
思考:右图是二氧化硅晶体的一部分,立方体体心的黑点表示一个硅原子,
在图中画出与硅原子相连的氧原子所在的位置。
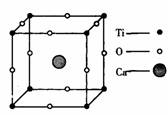
1.概念:描述 叫做晶胞;整块晶体由晶胞“无隙并置”而成;晶胞①中Ti、O、Ca原子数分别为 、 、 ;晶胞②中A、B、C、D原子数分别为 、 、 、 。

分子晶体中分子间尽可能采用紧密排列方式,分子的排列方式与其形状的关;离子晶体可视为不等径圆球的密堆积,离子晶体中正负离子的配位数主要由正负电荷的 (几何因素)、正负电荷的 (电荷因素)以及离子键的纯粹程度(键性因素)决定;金属晶体的结构可以归结为等径圆球的堆积,可分为Po的简单立方堆积、 型、 型和 型。
(1)晶体是内部微粒(原子、离子、分子)在空间按一定规则做 构成的 物质,晶体区别于非晶体的三个特征是:具有 的几何外形,各向 和具有固定的 。
(2)根据晶体内部微粒的 的微粒间 的不同可以将晶体分为通过离子键形成的 晶体,以金属键基本作用形成的 晶体,通过价键形成的 晶体和通过分子间相互作用形成的 晶体。
(3)常见晶体类型比较:
|
晶体类型 类型 比较 |
分子晶体 |
原子晶体 |
离子晶体 |
金属晶体 |
|
|
构成晶体 微粒 |
|
|
|
|
|
|
形成晶体微粒间作用力 |
|
|
|
|
|
|
作用力大小决定因素 |
|
|
|
|
|
|
物理性质 |
熔沸点 |
|
|
|
|
|
硬度 |
|
|
|
|
|
|
导电性 |
|
|
|
|
|
|
传热性 |
|
|
|
|
|
|
延展性 |
|
|
|
|
|
|
溶解性 |
|
|
|
|
|
|
典型实例 |
P4、干冰、硫 |
金刚石、SiO2 |
NaCl、KOH、NH4Cl |
金属单质 |
25、(17分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
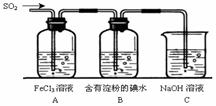 (1)SO2气体还原Fe3+的产物是 、
(1)SO2气体还原Fe3+的产物是 、
(填离子符号),参加反应的SO2和Fe3+的
物质的量之比是 。
(2)下列实验方案适用于在实验室制取所需SO2
的是 (填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F. 坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的 , 原因是
(6)能表明I-的还原性弱于SO2的现象是 。30.(13分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质、结构信息 |
价电子数为5的短周期元素;该元素形成的双原子分子一般情况下很稳定。 |
基态原子的M层有1对成对的p电子。 |
第三周期中第一电离能最小的元素 |
原子最外电子层上s电子数等于p电子数。单质为空间网状晶体,具有很高的熔、沸点。 |
(1)写出元素B基态原子的电子排布式___________________________。
(2)元素A形成的气态氢画物的空间构型为______________________。
(3)元素B的氢化物熔点比水低,原因是_______________________。
(4)元素B和元素C形成的化合物属于_____(填“离子”“原子”或“分子”)晶体。
(5)元素D形成的化合物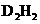 .其中D原子采用 杂化;
.其中D原子采用 杂化;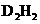 分子中含_____个
分子中含_____个 键、____个
键、____个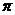 键,其中1个
键,其中1个 键的键能____(填“大于”、“小于”或“等于”)1个
键的键能____(填“大于”、“小于”或“等于”)1个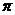 键的键能。
键的键能。
24.(16分)一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+ 3H2O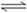 2NH3+
2NH3+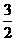 O2.进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
O2.进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
|
T/℃ |
30 |
40 |
50 |
生成NH3量/(10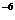 mo1) mo1) |
4.8 |
5.9 |
6.0 |
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为
 ;
;
(2)该反应过程与能量关系可用右图表示.完成反应的热化学方程式:
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议 ;
(4)工业合成氨的反应为N2(g)+3 H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
① 该条件下反应2NH3(g)
 N2(g)
十3H2(g)的平衡常数数值为
N2(g)
十3H2(g)的平衡常数数值为
。
② 相同条件下,在另一相同容器中充人a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.80 mo1,H2为2.0 mol,则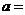 _____,
_____,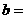 _______。
_______。
23.(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:
①上述反应体系中化学反应方程式为 ;
 ②膦(PH3)在水中的溶解度远小于氨的原因是_______________________。
②膦(PH3)在水中的溶解度远小于氨的原因是_______________________。
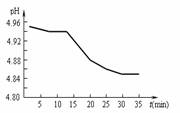
(2)SO2的排放是造成酸雨的主要因素。某地区酸雨pH
随时间的变化如下图所示。请用化学方程式表示
该地区酸雨pH随时间增加而减小的原因:
。
(3)生活污水中含大量细小的悬浮物,可加入某些物质
使之聚集成较大的颗粒而沉淀。请你举一种常见的
能使生活污水中悬浮物聚沉的物质,其化学式为 。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574
kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com