
题目列表(包括答案和解析)
4. 金属化学性质的一般规律
|
金属活动顺序表 |
K、Ca、Na |
Mg、Al |
Zn、Fe、Sn、Pb |
(H) |
Cu、Hg、Ag |
Pt、Au |
|
金属原子失电子能力(或还原性) |
强→弱 |
|||||
|
金属阳离子得电子能力(或氧化性) |
弱→强 |
|||||
|
与氧气作用 |
常温下易被氧化(保存在煤油中) |
常温下生成氧化膜 |
常温下跟O2反应缓慢 |
|
加热能被氧化 |
不能被氧化 |
|
与水作用 |
与冷水剧烈反应生成碱和H2 |
与热水或沸水缓慢反应生成氢氧化物和H2 |
与高温水蒸气反应生成氧化物和H2 |
|
与水不反应 |
|
|
与酸作用 |
能置换出非氧化性酸(如盐酸、稀H2SO4)中的氢 |
|
能跟氧化性酸(如HNO3、浓H2SO4)反应,但不生成H2 |
与王水反应 |
||
|
与盐溶液作用 |
首先与水反应,生成的碱与盐起复分解反应 |
一般是位于金属活动性顺序前边的金属能从盐中置换出后边的金属 |
||||
|
与强碱作用 |
仅Al、Zn与强碱溶液反应,生成H2和偏铝酸盐或锌酸盐 |
3. 金属的物理性质
(1)状态:通常情况下,除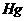 外其他金属都是固态。
外其他金属都是固态。
(2)金属光泽:多数金属具有光泽。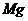 、
、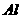 、
、 、
、 在粉末状态时也有光泽,其他金属在块状时才表现出来。
在粉末状态时也有光泽,其他金属在块状时才表现出来。
(3)易导电、导热:由于金属晶体中自由电子的运动,使金属易导电、导热。
(4)有延展性:与金属晶体中的自由电子跟金属阳离子的作用(金属键)有关。延展性最好的是铂(Pt),展性最好的是金(Au)。
(5)熔点及硬度:与金属键的强弱有关。熔点最高的是钨(W),最低的是汞(Hg);硬度最大的是铬(Cr)。
2. 金属的分类
(1)冶金工业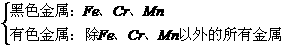
(2)按密度分
(3)按存在丰度分
1. 金属元素在周期表中的位置和原子结构特点
在元素周期表中,金属元素位于从硼到砹对角线的左方,包括IA、IIA、过渡元素和IVA-VIA的部分元素共90种,占目前已发现的112种元素的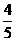 。
。
金属元素的原子最外电子层上的电子数一般为1-3个,原子半径比同周期的非金属元素的原子半径大,在化学反应中易失电子变成阳离子,因而只具有还原性。
2. 练习知识的综合运用能力
1. 对金属元素性质进行归纳总结
金属知识规律总结
18、3-甲基香豆素有香草味,可用于香料及化妆品,其结构简式为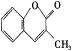 。关于它的说法正确的是( )
。关于它的说法正确的是( )
A.分子式为C10H10O2
B.分子中所有原子可能在同一平面上
C.1 mol该有机物与Br2的CCl4溶液发生加成反应,可以消耗5 mol Br2
D.1 mol该有机物与NaOH溶液反应,可以消耗2 mol NaOH
17、1mol某有机物 与足量NaOH溶液充分反应,消耗NaOH的物质的量是( )
与足量NaOH溶液充分反应,消耗NaOH的物质的量是( )
A.2mol B.3mol C.4mol D.5mol
16、中草药秦皮中含有的七叶树内酯
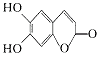 (每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和氢氧化钠溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和氢氧化钠溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
A.2 mol Br2 2 mol NaOH B.2 mol Br2 3 mol NaOH
C.3 mol Br2 4 mol NaOH D.4 mol Br2 4 mol NaOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com