
题目列表(包括答案和解析)
12.已知在晶体中仍保持一定几何形状的最小单位称为晶胞。干冰晶胞是一个面心立方体,在该晶体中每个顶角各有1个二氧化碳分子,每个面心各有一个二氧化碳分子。实验测得25℃时干冰晶体的晶胞边长为acm,其摩尔质量为Mg/mol,则该干冰晶体的密度为(单位:g/cm3)( )
A.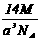 B.
B.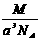 C.
C.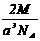 D.
D.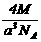
11.下列关于杂化轨道的叙述中,不正确的是( )
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子
C.[Cu(NH3)4]2+和CH4两个分子中中心原子Cu和C都是通过sp3杂化轨道成键
D.杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
|
A.常压下,四种元素的单质中,W单质的熔点最高
B.X的气态氢化物比Y的气态氢化物稳定
C.Z的阳离子与Y的阴离子电子层结构相同
D.W元素的金属性比Z元素的金属性强
10.有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为( )
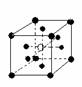
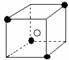
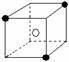
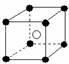
A B C D
8.已知乙烯分子中碳原子以3个sp2杂化轨道与碳原子或氢原子形成σ键,两个碳原子上未参与杂化的p轨道形成π键。下列关于乙烯分子的叙述中正确的是( )
A.乙烯分子2个碳原子或4个氢原子不可能在同一个平面内
B.乙烯分子中键角约为109°28′,所有原子在同一个平面内
C.乙烯分子中碳碳双键的键能比乙烷分子中碳碳单键的键能小
D.乙烯比乙烷活泼,说明碳碳之间的π键比σ键键能小,易发生反应
7.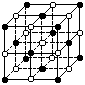 纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面微粒数占总微粒数的百分数为( )
纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面微粒数占总微粒数的百分数为( )
A.33.3%
B.50%
C.87.5%
D.96.3%
6.超临界流体是物质介于气态和液态之间的一种新的状态。目前应用最广的是超临界二氧化碳,在化学工业上可取代氟利昂等溶剂、发泡剂。下列有关超临界二氧化碳的说法中错误的是( )
A.超临界二氧化碳是新合成的一种物质
B.超临界二氧化碳由CO2分子构成
C.用超临界二氧化碳溶解物质后,可在常温常压下使二氧化碳挥发除去
D.用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
5.下列说法正确的是( )
A.分子间作用力越强,分子越稳定
B.冰融化是水分子中共价键被破坏
C.原子晶体中共价键越强,其熔点越高
D.氯化钠熔化时离子键未被破坏
4.下列叙述正确的是( )
A.离子晶体中一定含有活泼金属元素的离子
B.原子晶体都是化合物
C.固态不导电、水溶液能导电,这一性质能说明某晶体一定是离子晶体
D.离子晶体一般具有较高的熔点
3.氯化硼的熔点为-1070C,沸点为12.50C,在其分子中键角为1200,它能水解,有关叙述正确的是( )
A.氯化硼液态时能导电而固态时不导电
B.氯化硼中心原子采取sp杂化
C.氯化硼分子呈正三角形
D.氯化硼分子是由极性键构成的极性分子
2.下列说法正确的是( )
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com