
题目列表(包括答案和解析)
1.下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
|
Z |
|
|
|
|
|||||||||||||
|
|
|
M |
L |
Q |
R |
|
|
||||||||||
|
D |
A |
|
|
T |
X |
Y |
|
||||||||||
|
E |
|
|
|
|
|
|
|
|
J |
|
|
|
|
|
|
|
|
(1)Y分别与D、E形成的化合物中熔点较高是 ▲ (用化学式表示);T、X、Y原子的第一电离能由小到大的顺序是 ▲ (用元素符号表示)。
(2)LX2分子的电子式是 ▲ ,XY2分子是 ▲ (填“极性分子”或“非极性分子”);QY3分子中Q采用 ▲ 杂化。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则J原子的核外电子排布式是 ▲ (基态);与配体粒子互为等电子体的离子是 ▲ ;J(LR)4固态时属于 ▲ 晶体(填晶体类型)
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多同分异构体(其中Q以三个单键与其它原子相连),写出其中沸点最低的物质结构简式 ▲ 。
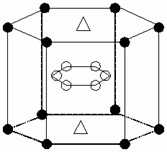
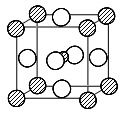
(5)A与M组成的一种化AM2,刷新了金属化合物超导 温度的最高记录。右图中所示的是该化合物的晶体结构单元。图中上下底面中心“Δ”处的原子是 ▲ (填元素符号)。

 2.二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是[B]
2.二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是[B]
A.S2Cl2的电子式为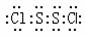
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:
2S2Cl2+2H2O=SO2↑+3S↓+4HCl
1.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
1.不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀。
(1)基态碳(C)原子的轨道表示式为 。
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为 ;已知CrO5中Cr为+6价,则CrO5的结构式为 。
(3) 与铜属于同一周期,且未成对价电子数最多的元素基态原子外围电子排布式为 。
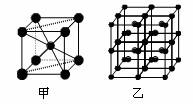
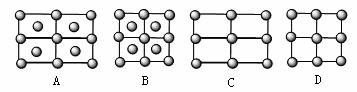
(4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~B图中正确的是 。
(5)据报道,只含镁、镍和碳三种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中每个镁原子周围距离最近的镍原子有
个。
|
(6)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ,其中心原子的杂化方式为
19.(12分)推断下列化合物的化学式:
⑴X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是_____;若XY2是共价化合物其化学式是______。
⑵第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为______。
⑶1mol某共价化合物,含有三种短周期元素的原子各1mol,且三种元素分别属于不同的周期,其质子总数为26mol,其中一种元素的最外层有7个电子,则该物质的化学式为______。
⑷某非金属X的最低负价为-2,它的最高价氧化物对应的水化物为强酸,则这种酸的化学式是________。
⑸X元素的最高正价和负价绝对值之差为6,Y元素的化合价为+1,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是_________ 。
20.(12分)1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是____________,理由是:
_________________________________________________________。
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)
___________________,并简述其理由:________________________________。
(3)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算确定C70分子中五边形和六边形的数目:C70分子中所含五边形数为____________,六边形数为_________。
18.(8分)C60、金刚石和石墨的结构模型如下图所示(石墨仅表示出其中的一层结构):
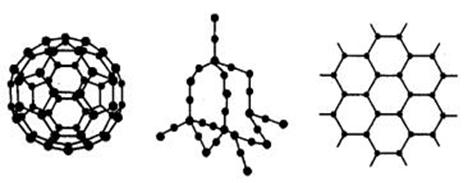 (1)C60、金刚石和石墨三者的关系互为________。
A、同分异构体 B、同素异形体
C、同系物 D、同位素
(2)固态时,C60属于________晶体(填“离子”“原子”或“分子”)
(1)C60、金刚石和石墨三者的关系互为________。
A、同分异构体 B、同素异形体
C、同系物 D、同位素
(2)固态时,C60属于________晶体(填“离子”“原子”或“分子”)
(3)硅晶体的结构跟金刚石相似,二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________。 (4)石墨层状结构中,平均每个正六边形占有的碳原子数是_________。
17.(8分)有关物质的熔、沸点数据如下表:
|
|
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
熔点/℃ |
2852 |
2072 |
741 |
190(2.5×105Pa) |
|
沸点/℃ |
3600 |
2980 |
1412 |
182.7 |
请参考上述数据填空和回答问题。
(1)工业上常用电解熔融MgCl2的方法生产金属镁,不用电解熔融MgO的方法生产镁,原因是 能用电解熔融AlCl3的方法生产铝吗? (填能或不能),原因是:
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是:
。
16.(20分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号和电子排布式:
X_____ __ __ Y____ _____
Z___ _ _____ W____ _____
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为________________________ ______。E分子的空间构型为_________。E在催化剂存在的条件下可用于还原汽车尾气中的______,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为___________ __________________ __________
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序)为 ,该化合物的水溶液与足量NaOH溶液反应的化学方程式为 ____________ __ __
15.(12分)请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请猜测NCl3水解的主要产物是 (填化学式)。
14.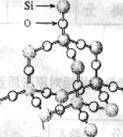 二氧化硅晶体是空间网状结构,如右图所示。关于二氧化硅晶体的下列说法中,不正确的是( )
二氧化硅晶体是空间网状结构,如右图所示。关于二氧化硅晶体的下列说法中,不正确的是( )
A.1 mol SiO2 晶体中Si-O键为2mol
B.晶体中Si、O原子个数比为1:2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
二卷(主观题,共72分)
13.下列物质性质的变化规律与分子间作用力有关的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com