
题目列表(包括答案和解析)
2、下列能发生的反应中, 离子方程式正确的是 ( )
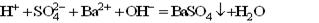 A.硫酸与氢氧化钡溶液混合
A.硫酸与氢氧化钡溶液混合
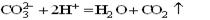 B.碳酸钙和盐酸混合
B.碳酸钙和盐酸混合
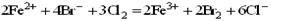 C.足量的氯气通入溴化亚铁溶液中
C.足量的氯气通入溴化亚铁溶液中
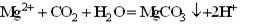 D.氯化镁溶液中通入二氧化碳
D.氯化镁溶液中通入二氧化碳
①合事实:离子反应要符合客观事实,不可臆造产物及反应。有些应该考虑到后续反应。
②式正确:化学式与离子符号使用正确。
③号实际:“=”“ ”“→”“↑”“↓”等符号符合实际。
”“→”“↑”“↓”等符号符合实际。
④双守恒:两边原子数、电荷数必须守恒(氧化还原反应中还要遵循电子守恒)。
⑤明类型:依据离子反应原理,分清类型,总结方法技巧。
⑥细检查:结合书写离子方程式过程中易出现的错误,细心检查。
无论是哪种考试模式,该题型是年年高考必考题型,分值在 “3+小综合”考试模式中至少占25分。(含后面无机推断题中写离子方程式)
综合看应该是“符合实际三守恒,分离原则要记清。等号可逆沉与气,仔细检查便告成。”
请认真完成下面练习。
1、下列离子方程式中, 正确的是 ( )
A.硫化亚铁跟盐酸反应 2H++S2- = H2S ↑
B.稀硫酸跟氢氧化钡溶液反应
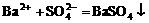
C.铁跟三氯化铁溶液反应 Fe+Fe3+=2Fe2+
D.亚硫酸钠跟硫酸溶液反应
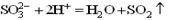
①强酸、强碱和易溶于水的盐改写成离子形式,难溶物质、难电离物质、易挥发物质、单质、氧化物(金属氧化物在熔融状态下拆如Al2O3制Al)、非电解质等均写化学式。
②微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。微溶物作为生成物,一般写化学式(标↓号),如石灰水和石灰乳:石灰水写成离子式而石灰乳则写化学式。
③氨水作反应物写NH3·H2O;作生成物,若有加热条件或浓度很大时,写NH3 (标↑号)。
④固体之间反应不能写离子方程式,如氯化铵与氢氧化钙的反应;浓H2SO4与固体反应不能写离子方程式。
⑤离子方程式要做到质量和电荷双守恒。
⑥—些特殊的反应[如有酸式盐参加或生成的反应,两种或两种以上的离子被一种物质氧化或还原,Ba(OH)2与KAl(SO4)2按不同比例反应等]要考虑并满足反应物物质的量的比值。
⑦多元弱酸酸式酸根离子,在离子方程式中不能拆开写,如HCO3- 、HS-、HSO3-、H2PO4-、HPO42-.
荆连友
17.略
16.略
15.(1) O2(1分),HCl(1分)
(2) 3Fe + 4H2O
 Fe3O4
+ 4H2(3分)
Fe3O4
+ 4H2(3分)
(3) Fe3++ 3SCN-= Fe(SCN)3(3分) (4) 无色(1分)
(5) 在酸性条件下,Cl-也能将MnO4-还原,使其褪色(2分)
14.⑴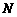
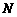 (2分)
(2分)
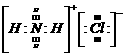 (2分)
(2分)
⑵①②③④⑥(2分) ④(2分)
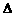 ⑶
⑶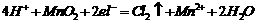 (2分)
(2分)
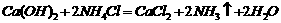
(4)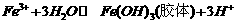 (2分)
(2分)
13.(1) 折线型 平面三角形
(2) H2SO3 + 2H2S = 3S↓+ 3H2O
(3) Cu + 2H2SO4(浓)
 CuSO4+ 2H2O
+ SO2↑(或C + 2H2SO4(浓)
CuSO4+ 2H2O
+ SO2↑(或C + 2H2SO4(浓)
 CO2↑+ 2H2O
+ 2SO2↑或Na2SO3+ H2SO4)
CO2↑+ 2H2O
+ 2SO2↑或Na2SO3+ H2SO4)
 Na2SO4+
H2O + SO2↑)
Na2SO4+
H2O + SO2↑)
(4) ①H2SO3 + 2OH-= H2O + SO32-
② > SO32-+ H2O HSO3-+ OH-
HSO3-+ OH-
③增大 升温,SO32-水解程度增大,OH-浓度增大,pH增大 K2SO4
12.略
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com