
题目列表(包括答案和解析)
氧化还原反应的实质是电子的 (包括电子的得失或电子对的偏移),特征是反应前
后 ;判断某反应是否属于氧化还原反应可根据反应前后 是否发生了变化这一特征。
28.(04上海卷)某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→MnSO4 + I2 + KIO3 + K2SO4 +H2O
(1)该反应的氧化剂是 。
(2)如果该反应方程式中I2和KIO3的系数都是5:
①KMnO4的系数是 。
②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 → MnSO4 + I2 + KIO3 + K2SO4 + H2O
(3)如果没有对该方程式中的某些计量数作限定,可能的配平计量数有许多组。原因是
。
27.(2005上海卷)某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
26.(2006上海卷)(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________→__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质 ,被还原的元素是 。
(3)反应中1 mol氧化剂 (填“得到”或“失去”) mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
 __________ + __________→
__________ + __________→
25.(07上海卷)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3- +4H++3e- = NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_______________________________________。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是 mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
24.(08上海卷)某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外谁反应物与生成物分别填入以下空格内。
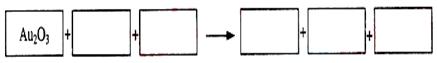
(2)反应中,被还原的元素是_______,还原剂是____________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。
23.(08全国Ⅰ卷)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转化为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。
请回答:
(1)软锰矿制备K2MnO4的化学方程式是 。
(2)K2MnO4制备KMnO4的离子方程式是 。
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量。
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2该反应的化学方程式是
。
(5)上述制得的KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应完全,计算该KMnO4的纯度。
22.(08天津卷)(1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___ mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
21.(08宁夏卷)
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580mL(标准状况);
方案二:将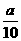 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1
的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)在滴定实验中不能选择 式滴定管,理由是 ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和
;(铁的相对原子质量以55.9计)
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一 (填“准确”“不准确”“不一定准确”),理由是 ;
②方案二 (填“准确”“不准确”“不一定准确”),理由是 。
20.(05江苏卷)Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com