
题目列表(包括答案和解析)
10、在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol·L-1 (忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数
答案、(6分)(1)Na2O+H2O = 2NaOH, 2Na+2H2O = 2NaOH+H2↑, 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑。
(2)n(NaOH余) = 2.0 L×0.05 mol·L-1 = 0.1 mol,
n(H2) =0.05 mol,n(Al) = 0.01 mol = n(NaAlO2),由电子守恒知:n(Na)+3n(Al) = 2n(H2),即:n(Na)+3×0.01 mol = 2×0.05 mol,得:n(Na) = 0.07 mol。
由钠守恒知:n(NaAlO2)+n(NaOH) = n(Na)+2n(Na2O),即:0.01 mol+0.1 mol = 0.07 mol+2n(Na2O),
得:n(Na2O) = 0.02 mol。
w (Na) ≈89%。
9、某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1-2 min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应.
 (1).此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式___________、____________。
(1).此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式___________、____________。
此方案第一步的实验装置如右图所示:
(2).加入反应物前,如何检查整个装置的气密性: ___________________________________________ __.
(3).装置B中盛放的试剂是______________,作用是_________________。
(4).在实验室通常制法中,装置A还可作为下列________________气体的发生装置(填序号).
①CH2==CH2 ②NH3 ③ O2 ④ H2
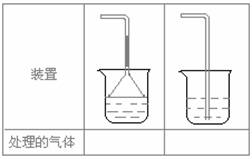
(5).实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内.
(6).已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g / mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为____________________.
答案、(共18分)
(1) 2NaOH + CO2 == NaHCO3 (2分) NaHCO3 + NaOH == Na2CO3 + H2O (2分)
(2)方法①:用弹簧夹夹住A、B连接处,先检查A的气密性:塞紧橡皮塞,从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,停止加水后,漏斗内与锥形瓶中的液面差保持不变,说明装置不漏气.然后检查B的气密性:向烧杯中注入少量水,使导管口侵入水中,双手捂住广口瓶片刻有气泡冒出,松开手后,有少量水进入导管形成水柱,说明装置不漏气.
方法②:也可一次检查A、B的气密性:连接B和烧杯间的乳胶管用止水夹夹住.然后从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气. (2分)
(3) 饱和碳酸氢钠溶液 吸收HCl气体 (各2分)
(4) ②④ (2分) (5) ①③ ②④ (各2分) (6) 7.2 mol/L (2分)
8.向某NaOH溶液中通人CO2气体后得溶液M,因CO2通人量的不同,溶液M的组成也不同。若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)[CD]
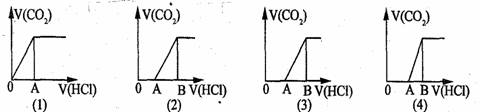
A.M中只有一种溶质的有(1)和(3) B.M中有两种溶质的有(2)和(4)
C.(2)图显示M中c(NaHCO3)>c(Na2CO3) D.(4)图显示M中c(NaOH)>c(Na2CO3)
7.在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高[B]
A.所用NaOH已经潮解 B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里 D.称量时误用“左码右物”
6.把等量金属钠进行下列实验,其中生成氢气最多的是[D]
A.把钠放入足量稀盐酸中 B.把钠放入足量水中
C.把钠放入硫酸铜溶液中 D.将钠用铝箔包好并刺些小孔,再放入水中
5.我国化学家侯德榜改革国外的Na2CO3生产工艺,创造了侯氏制碱法,又叫联碱法,该法是将合成氨工厂生产的NH3及副产品CO2,通入到饱和食盐水中得到NaHCO3,分离出的NaHCO3加热制得Na2CO3。某研究性学习小组设计如下图所示的模拟装置,该装置可实现部分原料的循环使用。
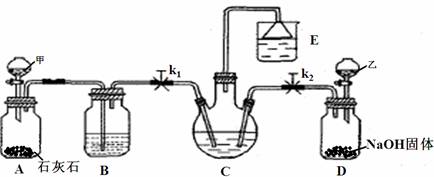 (1)分液漏斗甲中为盐酸,装置B中试剂为 ▲ ,分液漏斗乙中是易挥发的某试剂,该试剂为 ▲ 。
(1)分液漏斗甲中为盐酸,装置B中试剂为 ▲ ,分液漏斗乙中是易挥发的某试剂,该试剂为 ▲ 。
(2)实验操作过程中,应先打开 ▲ (填“k1”或“k2”),当观察到 ▲ 现象时,再打开另一个弹簧夹。
(3)装置E中试剂为饱和NaCl溶液,该装置能体现绿色化学思想的两个作用是 ▲ 、 ▲ 。
(4)老师认为在C、D之间还应增加一个装置,该装置作用为 ▲ 。
答案.(10分)(1)饱和NaHCO3溶液,浓氨水(4分) (2)k2,E中漏斗有液面上升时(2分)
(3)吸收氨气防止污染;获得NaCl和氨水的饱和液循环使用。(2分)
(4)防止倒吸(2分)
4.  CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是[D]
CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是[D]
A.Cs显+3价,I、Cl均显-1价
B.Cs显+1价,Cl显+1价,I显-1价
C.在CsICl2溶液中通入Cl2,有单质碘生成
D.在CsICl2溶液中通入SO2气体,有硫酸生成
3. 钠、铁两种金属单质及其化合物在生产、生活中有着广泛的应用。请回答:
(1)两种金属中,最高价氧化物的水化物属于强碱的是____,由此说明,钠的金属性比铁____(填“强”或“弱”)。
(2)某些补铁剂的成分是硫酸亚铁,长期放置会因氧化而变质。检验硫酸亚铁是否变质的试剂是____(填序号)。
① 稀盐酸 ② 石蕊溶液 ③ KSCN溶液
(3)向硫酸亚铁溶液中滴入氢氧化钠溶液,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色,此过程中涉及的氧化还原反应的化学方程式为 。
答案.(4分) (1)Na …………………………………………………………………1分
强 …………………………………………………………………1分
(2) ③ …………………………………………………………………1分
(3)4Fe(OH)2+O2+2H2O = 4Fe(OH)3 ……………………………… 1分
2.金属冶炼技术随人类对自然界认识的不断深入而发展。下列金属中,常用作还原剂冶炼其他金属的是[D]
A.Ag B.Cu C.Fe D.Al
1.向盛有无水乙醇的烧杯中投入一小块金属钠,可以观察到的现象是[B]
A.钠块在乙醇液面上四处快速游动钠块
B.开始时钠块沉在乙醇液面下
C.熔成小球
D.钠块表面有大量气泡迅速产生,比水反应剧烈
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com