
题目列表(包括答案和解析)
15.将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是[A]
A.3摩/升HCl B.4摩/升HNO3 C.8摩/升NaOH D.18摩升H2SO4
14.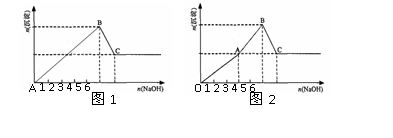 Mg2+和Al3+的混和溶液中逐滴加入NaOH溶液,形成沉淀的情况出现两种图示。图1为小杨同学绘制,图2是小周根据实验结果绘制,查阅沉淀生成和Al(OH)3溶解的pH情况如表。下列说法正确的是[CD]
Mg2+和Al3+的混和溶液中逐滴加入NaOH溶液,形成沉淀的情况出现两种图示。图1为小杨同学绘制,图2是小周根据实验结果绘制,查阅沉淀生成和Al(OH)3溶解的pH情况如表。下列说法正确的是[CD]
 A. 据图计算得n(Mg2+): n(Al3+)=2:1
A. 据图计算得n(Mg2+): n(Al3+)=2:1
B. 小周实验中,OA段生成两种沉淀
C. 图2中OA段表示仅生成Al(OH)3沉淀,AB段仅生成 Mg(OH)2
D. 结合表中数据和图2分析,AB段可能发生:Mg2++2AlO2-+4H2O =2Al(OH)3↓+Mg(OH)2↓
13. 将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( BD )
A.1:3 B.2:3 C.1:4 D.2:7
12. 把铝粉和某铁的氧化物(xFeO·yFe2O3)粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放人足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是5 : 7,则x : y为[B]
A、1∶1 B、1∶2 C、5∶7 D、7∶5
11. 根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是[AC]
A、HCO3- B、CO32- C、Al(OH)3 D、CH3COOH
10.下列现象或反应的原理解释正确的是[D]
|
|
现象或反应 |
原理解释 |
|
A. |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
|
B. |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
|
C. |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
|
D. |
2CO=C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |
9、锌铝合金的主要成分有Zn、Al、Cu、Si等元素。实验室测定其中Cu含量的步骤如下:①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中。
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3-4,加入过量KI溶液(生成CuI和I2)和指示剂,用0.01100mol×L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2 + 2S2O32- = 2I- + S4O62-),消耗Na2S2O3溶液6.45mL。
(1)写出步骤①溶解Cu的离子方程式 。
(2)判断步骤②滴定终点的方法是 。
(3)计算合金中Cu的质量分数(要有计算过程,否则不得分)
答案.(1)Cu+2H++H2O2==Cu2++2H2O (2分)
(2) 淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去。(2分)
(3)n(Cu)=1/2n(I2) = n(S2O32-)=6.45×0.01100=0.07095mmol
ωCu=0.07095×10-3×64×250.00/50.00/1.1=0.02064(4分)
8、 某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl3中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下的体积):
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl3中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下的体积):
(1)混合物中是否存在FeCl2 (填“是”或“否”); ,
(2)混合物中是否存在(NH4)2SO4 (填“是”或“否”),你的判断依据是_______。
(3)写出反应⑤的离子反应方程式; 。
(4)请根据图中数据分析,原固体混合物中一定含有的物质为 (写化学式)。
(5)把AlCl3溶液加热浓缩蒸干,不能得到较纯的A1Cl3晶体,请你设计一个可行的简易实验从溶液中得到较纯的AlCl3结晶: 。
答案.(1)否(2分) (2)是(2分) 气体通过浓硫酸减少4.48L(1分)
(3)A1(OH)3++3H+=A13++3H2O(2分)
(4)一定含有A1、(NH4)2SO4和MgCl2三种物质(3分)
(5)往氯化铝溶液中加入一定量的浓盐酸后,再加热浓缩析出晶体。(2分)
7、将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
A.最终得到7.8g的沉淀 B.反应过程中得到6.72L(标准状况)的气体
C.最终得到的溶液中c(NaCl)=1.5mo/L D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
6、将Na2O2、HCl和Al2O3一起溶于一定量的水中,完全反应后,测得所得溶液中只含有Na+、AlO2-、Cl- (不考虑AlO2-的水解和H2O的电离),则Na2O2、HCl、Al2O3的物质的量之比不可能是
A.2∶2∶1 B.3∶3∶1 C.3∶4∶1 D.4∶6∶1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com