
题目列表(包括答案和解析)
3.下列单体在一定条件下能发生加聚反应生成
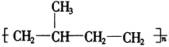 的是( )
的是( )
A. 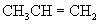 和
和

B. 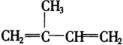
C. 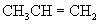 和
和

D. 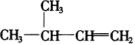
2.现有两种高聚物A、B,A能溶于氯仿等有机溶剂,B不溶于任何溶剂,加热不会变软或熔融,则下列叙述中不正确的是( )
A.高聚物A可能具有弹性,而高聚物B一定没有弹性
B.高聚物A一定是线型高分子化合物材料
C.高聚物A一定是体型高分子化合物材料
D.高聚物B一定是体型高分子化合物材料
(每小题有1-2个选项符合题意)
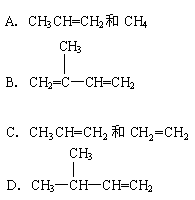
1.下列单体在一定条件下能发生加聚反应生成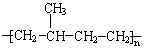 的是
的是
22.有100 mL 溶质为MgCl2和AlCl3的混合溶液,c(Cl-)=1.0 mol·L-1,c(Mg2+)=0.2mol·L-1。若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol·L-1的NaOH溶液的体积是[C]
A.25mL B.5mL C.30mL D.100mL
21.平达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式碳酸盐,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g。试通过计算推测该碱式盐的化学式。
答案.
、(9分)n(CO32-)=0.005mol(2分),n(OH-)=0.08mol(2分),
n[Mg(OH)2]==0.03mol(2分),n(Al3+)=001mol(2分),
碱式盐中含有结晶水(1分),碱式盐的化学式为:Al2Mg6(OH)16CO3·4H2O(1分)。
20.(12分)工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下:
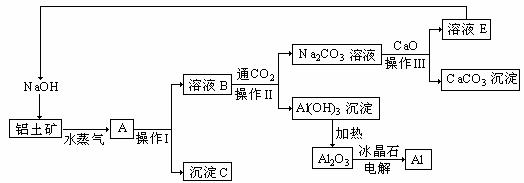
请回答下列问题:
(1)水蒸气的作用 。
(2)沉淀C的化学式为________,该物质除了用于金属冶炼以外,还可用作________。
(3)操作I、操作II、操作III都用到的玻璃仪器是有________________。
(4)实验室洗涤Al(OH)3沉淀应该如何操作: 。
(5)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
答案.、(12分)(1)加热加快反应 (2)Fe2O3 颜料;
(3)烧杯、漏斗、玻璃棒;
(4)用玻璃棒引流向过滤器中加水浸没沉淀,滤去洗液后,反复2到3次即可。;
(5)CaO和CO2 Fe2O3和O2;
19.某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是___________。(填序号)
A.铝与Cl-反应,铝与SO42-不反应 B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化 D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是 。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是 。
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是______。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
答案.(10分)(1)D(2分) (2)Cu(2分)
(3)H2(2分);①随着反应进行生成铝离子浓度增大,水解程度增大,产生H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解。(2分)
(4)A、B、D (2分)
18.最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺。这项技术具有广泛的能源潜在用途,包括为汽车提供原料、潜水艇提供燃料等。该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气。合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜。下列关于铝、镓的说法正确的是[D]
A.铝的金属性比镓强 B.铝的熔点比镓低
C.Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应
D.铝、镓合金与水反应后的物质可以回收利用冶炼铝
17.氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应
Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是[B]
2AlN+3CO合成。下列叙述正确的是[B]
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移3mol电子
C.AlN中氮元素的化合价为+3 D.AlN的摩尔质量为41g
16.冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是[C]
A.熔融的MgO不导电 B.MgO分子间作用力很大
C.MgO熔点高 D.MgO属原子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com