
题目列表(包括答案和解析)
7.下列有关说法正确的是
A.物质熔沸点的高低顺序是:晶体硅>氯化钠>冰>氖气
B.微粒半径由大到小顺序是:H->Li+>H+
C.溶液中结合H+能力由强到弱的顺序是:SO42- >H2PO4->CH3COO->HCO3-
D.CO2、HClO、CF4、PCl3四种分子中的所有原子都满足最外层为8电子的稳定结构
6.X、Y、Z为短周期元素,Z的原子序数等于X、Y的原子序数之和,且Z离子比X离子多三个电子层,下列推断不正确的是
A.Y的原子半径大于Z的原子半径 B.X可能为金属元素
C.Y与Z不可能形成离子化合物 D.Z一定为非金属元素
5.A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A.原子序数:A>B>C>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
4.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
3.在周期表的前三个周期中,位置相邻的三种元素的质子数之和为33,则有关这三种元素的下列说法正确的是
A.可能在同一周期 B.可能在同一主族
C.可能有两种元素在第二周期 D.可能有两种元素在第三周期
2.下列叙述正确的是
A.同周期元素的原子半径以ⅦA族的为最大
B.同主族两种元素原子的核外电子数的差值可能为36
C.短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D.科学家在周期表中金属与非金属分界线处找到了优良的催化剂
1.在元素周期表中,从左到右共有18个纵行。第1纵行(氢除外)为碱金属元素,稀有气体是第18纵行。下列说法中正确的是
A.铝元素位于第3纵行 B.过渡元素在周期表中占10个纵行
C.第17纵行所有元素的化合价都有+7价 D.第16纵行元素都是非金属元素
4.硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
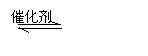
2SO2(g)+O2(g) 2SO3(g) △H=-98.3kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
。
3. 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺,请按要求回答问题:
(1)“氨碱法”产生大量CaC12废弃物,请写出该工艺中产生CaC12的化学方程式:
;
(2)写出“联合制碱法”有关反应的化验学方程式:
; 。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
2. 聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
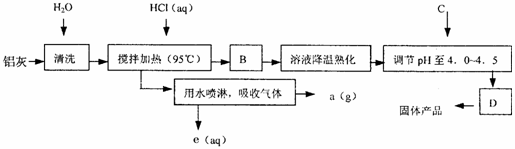
(1)搅拌加热操作过程中发生反应的离子方程式为:
; 。
(2)生产过程中B和D的操作名称分别是 和 (B和D均为简单操作)。
(3)反应中副产品a是 。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用 。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com