
题目列表(包括答案和解析)
7.水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32–+O2+xOH– =Fe3O4+S4O62–+2H2O,下列说法正确的是
A.硫元素被氧化,铁元素被还原 B.Fe2+、S2O32-都是还原剂
C.x=2 D.每生成1mol Fe3O4,则转移电子数为3mol
6.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2 B.Cl― C.Fe3+ D.NO3―
5.某学生设计了如图的方法对A盐进行鉴定:
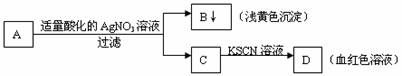
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
4.向氧化铜和铁粉的混合物中加入一定量的稀硫酸、微热,充分反应后过滤,再向滤液中插入锌片,有气泡产生.则以下判断正确的是
A.滤液中一定含有硫酸亚铁 B.滤液中一定含有硫酸铜
C.不溶物中可能含有氧化铜 D.不溶物中可能含有铁
3.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
③铝和硫直接化合可以得到Al2S3;铁和硫直接化合也可以得到 Fe2S3
④不能用电解熔融的AlCl3来制取金属铝;也不能用电解熔融的MgCl2来制取金属镁
A.① B.②③ C.④ D.①②③④
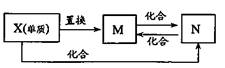
2.右图中,M、N为含X元素的常见化合物。
则X元素为
A.Fe B.Cu
C.N D.C
1.下列制取硫酸铜的实验设计能体现“经济、高效、环保”精神的是
A.铜与浓硫酸共热
B.用铜片为阳极,石墨为阴极,电解稀硫酸
C.先灼烧废铜屑生成氧化铜,然后再用浓硫酸溶解
 D.适当温度下,使铜片在持续通入空气的稀硫酸中溶解
D.适当温度下,使铜片在持续通入空气的稀硫酸中溶解
9.(20分)钨是我国丰产元素,是熔点最高的金属 , 广泛用于拉制灯泡的灯丝 , 有“光明使者”的美誉。钨在自然界主要以钨 (+6价) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙 (CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe,Mn)WO4。黑钨矿传统冶炼工艺的第一阶段是碱熔法:
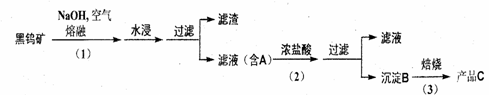
其中 A、B、C 都是钨的化合物。回答:
(1) 74W在周期表的位置是第 周期,第 族。
(2) 写出上述流程中 A 、B 、C 的化学式。
A_____________; B____________; C_____________
(3) 钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时 , 可用碳作还原剂。写出用碳还原氧化钨制取金属钨的化学方程式:______________________________________________________________;
为了获得可以拉制灯丝的高纯度金制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂 ,为什么 ?_____________________________________________。
(4) 仲钨酸的阱盐在热分解时会发生内在氧化还原反应 ,我国钨化学研究的奠基人顾冀东先生采用这一反应制得了蓝色的、非整比的钨氧化物 WO3-x。 这种蓝色氧化钨具有比表面大、易还原的优点 , 在制钨粉时温度容易控制 ,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析 , 得知蓝色氧化钨中钨的质量分数为 0.7985。
①计算 WO3-x中的x值。X=__________________
②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这两种价态的钨原子数比为________:________
8.(20分)某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
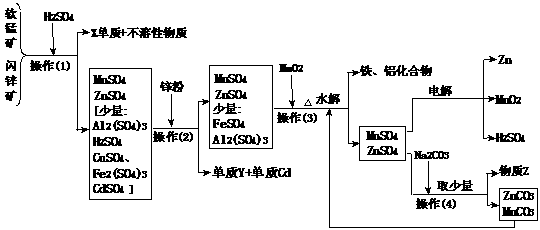
请回答:
(1)副产品X的名称是 ,Y的名称是 、Z的化学式为 。
(2)他们的主要产品中的元素在周期表中,锌属 族,X在 周期。
(3)图中“操作(1)~(4)”都包含的共同一种操作,在实验室中该操作的名称为 。
(4)操作(1)中,在稀H2SO4存在下MnO2把硫化物氧化成硫单质和+2价硫酸盐。如果硫化物用MS表示,请写出MnO2与硫化物反应的化学方程式: 。
(5)操作(3)生成的铁、铝化合物的化学式为 。
(6)请写出电解制得锌和二氧化锰的化学方程式 。
(7)旧工艺生产二氧化锰,是将软锰矿与煤混合粉碎后高温焙烧,再用硫酸浸取焙烧料净化后电解。对比旧工艺,新工艺有好多个优点,请你至少说出新工艺的一个优点: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com