
题目列表(包括答案和解析)
7.在一定温度下,向饱和烧碱溶液中放入少量过氧化钠,反应后回复到原来的温度,下列说法正确的是
A.溶液的pH增大,有O2放出 B.溶液的pH不变,有O2放出
C.溶液c(Na+)增大,有O2放出 D.溶液n(Na+)减小,有O2放出
6.取对水蒸气的相对密度为0.4的CO和H2组成的混合气体若干克,通入到盛足量的Na2O2固体粉末的容器中,并同时加入少量的O2,电火花引燃,充分反应后,称重发现固体粉末的质量增加了2.1g,则原混合气体的质量比为
A.1:4 B.2:3 C.6:5 D.7:2
5.许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律。如:Na2O2+SO2 == Na2SO4、2Na2O2+2SO3 ==2Na2SO4+ O2,据此,你认为下列方程式中不正确的是
A.2Na2O2+2Mn2O7==4NaMnO4+O2↑ B.2Na2O2+P2O3==Na4P2O7
C.2Na2O2+2 N2O3==4NaNO2+O2 D.2 Na2O2+2 N2O5 ==4NaNO3+O2↑
4.将4.34 g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672ml混合气体,将混合气体通电后恰好完全反应,则Na、Na2O、Na2O2的物质的量之比为
A.4∶3∶2 B.1∶2∶1 C.1∶1∶2 D.1∶1∶1
3.将钠、镁、铝各0.3mol分别放入100 mL1 mol·L-1盐酸中,同温同压下产生的气体的体积比是
A.1 : 2 : 3 B.6 : 3 : 2 C.3 : 1 : 1 D.1 : 1 : 1
2.下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③少量电石投入过量NaHCO3溶液 ④Na2O2投入FeCl2溶液
A.① B.③ C.②③ D.①③④
1.下列有关钠的叙述中,错误的是
A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等
B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C.在钠、钾、铷三种单质中,铷的熔点最高
D.钠的质地软,可用小刀切割
15.(12分)在标准状况下,取甲、乙、丙各30.0mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(设反应前后溶液体积不发生变化):
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
255 |
385 |
459 |
|
气体体积/ mL |
280 |
336 |
336 |
请回答:
(1)甲组实验中,盐酸(选填“过量”“适量”或“不足量”,下同) ;丙组实验中盐酸 。
(2)盐酸的物质的量浓度为 。
(3)合金中Mg、Al的物质的量之比为 。
14.(12分)金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
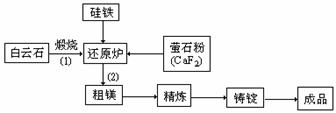
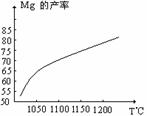
(1)在冶炼过程中反应温度对生成金属镁的影
响如图,从图中分析,还原反应的反应热
△H 0(填“<”“>”“=”);理由是:
。
(2)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
(3)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl••MgCl2• 6H2O),其中
KCl••MgCl2• 6H2O属于 。
A.复盐 B.混合物 C.配合物 D.混盐
(4)写出下列反应的方程式
①煅烧白云石 。
②CaO•MgO与Si的反应 。
13.(14分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),以探索工业废料的再利用。其实验方案
如下:
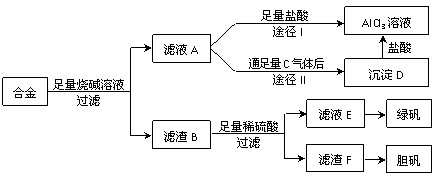

试回答下列问题:
(1)过滤用的玻璃仪器有 。
(2)写出滤液A转化为沉淀D的离子方程式 。
(3)由滤液A制AlCl3溶液的途径有Ⅰ和Ⅱ两条,你认为合理的是途径 (填“Ⅰ”或“Ⅱ”),理由是 。
(4)从滤液E中得到绿矾晶体的实验操作是 。
(5)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式为 。
(6)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理? ;理由是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com