
题目列表(包括答案和解析)
3.用0.1mol/L的NaOH溶液滴定100mL0.1mol/L盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的pH范围是
A.6.9-7.1 B.3.3-10.7 C.4.3-9.7 D.6-8
2.下列实验操作中所用的仪器合理的是
A.用25 mL的酸式滴定管量取14.80 mL的KMnO4溶液
B.用100 mL的量筒量取5.2 mL盐酸
C.用托盘天平称取25.20 g氯化钠
D.用250mL的容量瓶酸制所需的220mL 0.1mol·L-1的NaOH溶液
1.在一支25ml的酸式滴定管中盛入0.1mol·L-1HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.l mol·L-1NaOH溶液进行中和,则所需NaOH溶液的体积
A.大于20 mL B.小于20 mL C.等于20 mL D.等于5mL
15.(14分)氯酸钾是一种强氧化剂,多用来制造火柴和烟花等。制取氯酸钾的方法有两种:第一种,无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾。
①电解池中电极反应的方程式是
阴极: ,阳极: 。
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目 。
第二种,无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
③第二种方法中制得氯酸钾的化学方程式是 ,该反应能够进行的原因是 。
④已知下列各物质的价格如下表:
|
物质 |
NaCl |
KCl |
NaClO3 |
KClO3 |
KOH |
|
价格(元/50kg) |
500 |
1900 |
4200 |
26000 |
10600 |
从经济效益分析,上述方法中的第 种方法更好,理由是
。
14.(12分)北京市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配
料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20~50mg/kg |
|
分装时期 |
|
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中; b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
mg/kg。
13.(12分)随着经济的发展和人民生活水平的提高,近年来汽车拥有量呈较快增长趋势。
⑴乙丙橡胶(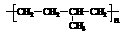 )因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
)因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
 ⑵金属防护对汽车工业具有重要意义。铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化铝薄膜,该氧化膜不溶于电解时使用的电解液--稀硫酸。写出该过程阳极反应的电极反应式
⑵金属防护对汽车工业具有重要意义。铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化铝薄膜,该氧化膜不溶于电解时使用的电解液--稀硫酸。写出该过程阳极反应的电极反应式
。
⑶在发动机和三元催化转化器间的尾气流中安装一个称为λ探测器的电化学元件,可测定λ(λ=入口处的空气量/完全燃烧需要的空气量)值,如右图所示。当汽车速度增加时,入口处的空气量增大,此时排出尾气中的主要污染物是 。在转化器的前半部,一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体,其反应的化学方程式为 。为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。已知:甲醇燃烧热为726kJ/mol。请写出甲醇燃烧的热化学方程式 。
12.(12分)汞单质及其化合物在工业生产和研究上有广泛的用途,汞唯一重要的矿源是朱砂(HgS)。朱砂炼汞的反应之一为: HgS + O2  Hg + SO2,请完成下列问题:
Hg + SO2,请完成下列问题:
(1) 上述的反应中,氧化剂是__________,每生成1molHg转移电子的物质的量为 。
(2) 电解某汞的硝酸盐溶液,当阴极消耗a mol金属阳离子时,可获得2a mol金属单质,同时阳极可得0.5a mol的气体产物。则该气体产物是____________(填化学式),由此可推断出该盐的化学式为_____________。其阴极上所发生的还原反应的方程式是___________________________
(3) 随着冶炼、电镀等工业生产的不断发展,所需汞及其化合物的用量也日趋增多,随之排放出来的含汞的废水也愈加严重,现已成为世界上危害较大的工业废水之一。请你提出一种处理含汞(Hg2+)废水的方法___________________________________
11.(10分)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。 。
(2)此反应的还原剂是 ,它的氧化产物是 。
(3) 此反应的离子反应方程式可表示为: 。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
10. 将AsO
将AsO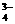 +2I-+2H+
+2I-+2H+ AsO
AsO +I2+H2O设计成右下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
+I2+H2O设计成右下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
甲组:向B烧杯中逐滴浓盐酸
乙组:向B烧杯中逐滴加入40%NaOH溶液
下列描述中,正确的是
A.甲组操作过程中,C2做负极
B.乙组操作过程中,C1上发生的电极反应为: 2I--2e-=I2
C.两次操作过程中,微安表(G)指针的偏转方向相反
D.甲组操作时该装置为原电池,乙组操作时该装置为电解池
班别 座号 姓名 评分
选择题答题表
9.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com